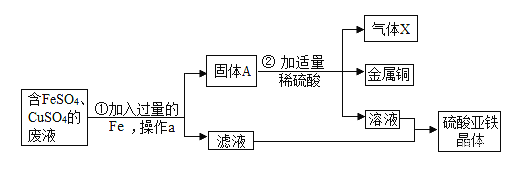
-
下列物质的用途利用了其物理性质的是( )
A.干冰用作制冷剂
B.焦炭用于炼铁
C.氢气用作高能洁净的燃料
D.氮气用于制备氮肥和燃料
难度: 简单查看答案及解析
-
分类是学习化学的方法之一。下列各组物质是按单质、氧化物、混合物的顺序排列的是( )
A.氧气、水、空气 B.氮气、氯酸钾、钢
C.天然气、干冰、冰水混合物 D.石墨、氢氧化钙、石油
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.碳-12原子和碳-13原子的中子数相同
B.KMnO4和K2MnO4中有相同的原子团
C.Fe2+和Fe3+都属于铁元素,核外电子数不同
D.
和
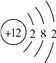 化学性质相同
化学性质相同难度: 中等查看答案及解析
-
下图表示某化学反应的微观示意图,依据图分析判断,下列说法正确的是
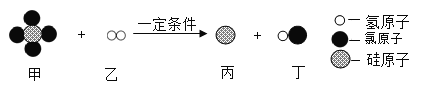
A. 甲物质由5个原子构成
B. 化学变化的后硅元素的化合价不变
C. 参加反应的乙的质量和生成的丁中氢元素的质量相等
D. 参加反应的甲、乙两种物质的分子个数比为l:1
难度: 中等查看答案及解析
-
在硫酸铜和硫酸亚铁混合溶液中加入镁粉,下列说法正确的是( )
A.镁粉无剩余,溶液中若有Cu2+,则必定有Fe2+
B.镁粉无剩余,溶液中若无Cu2+,则必定有Mg2+、Fe2+
C.镁粉有剩余,溶液中若有Mg2+,无Cu2+,可能有Fe2+
D.镁粉有剩余, 则溶液中有Mg2+、Fe2+,无Cu2+,
难度: 中等查看答案及解析
-
选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法正确的是( )

A.操作①和⑤中玻璃棒的作用是相同的
B.甲实验和乙实验都要用到的实验操作①
C.甲实验在操作⑤时,将水全部蒸发后停止加热
D.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
难度: 中等查看答案及解析
-
下面所示的四个图像,能正确反映对应变化关系的是
A.
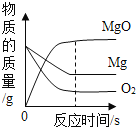 镁在氧气中燃烧
镁在氧气中燃烧B.
 向二氧化锰中加入过氧化氢溶液
向二氧化锰中加入过氧化氢溶液C.
向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D.
 等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应难度: 中等查看答案及解析