-
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标笠。下面所列物质,贴错了包装标签的是
A.
 氢氧化钠 B.
氢氧化钠 B.  汽油 C.
汽油 C.  酒精 D.
酒精 D.  烟花炮竹
烟花炮竹难度: 简单查看答案及解析
-
下列实验操作不正确的是
A. 蒸发结晶时,应将蒸发皿中的NaCl溶液全部蒸干才停止加热
B. 蒸馏实验中,要在烧瓶中加入沸石或碎瓷片,以防止液体暴沸
C. 蒸馏操作使用的温度计的水银球应与蒸馏烧瓶支管口平齐
D. 浓硫酸的稀释是将浓硫酸沿器壁慢慢地注入烧杯里的水中,并用玻璃棒不断搅拌
难度: 简单查看答案及解析
-
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是
A. 240mL0.2mol/L的NaCl溶液配制:需要使用天平、250mL容量瓶等仪器
B. 不慎将NaOH溶液到皮肤上,应立即用较多的水冲洗
C. 用CCl4萃取碘水中的碘时,萃取后的CCl4层应从分液漏斗下端放出
D. 实验室酒精起火,可以用水浇灭
难度: 简单查看答案及解析
-
下列装置与操作能与实验目的对应的是
A.
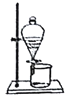 分离水和酒精 B.
分离水和酒精 B. 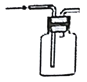 收集氢气
收集氢气C.
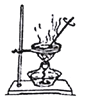 分离碘和苯 D.
分离碘和苯 D. 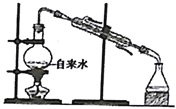 实验室制取蒸馏水
实验室制取蒸馏水难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,分子数为NA的CO2、N2O混合气体体积约为22.4L,质量为44克
B. 常温常压下,16gO2所含的原子数为NA
C. 由O2和NO2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D. 标准状况下,22.4LH2O所合的分子数为NA
难度: 中等查看答案及解析
-
胶体区别于其它分散系的本质特征是
A. 胶体粒子带电荷 B. 胶体粒子的直径在1~100nm之间
C. 胶体粒子能够发生布朗运动 D. 胶体粒子不能穿过半透膜
难度: 简单查看答案及解析
-
下列物质的分离方法正确的是
①用蒸馏法分离乙醇和水的混合物②用过滤的方法分离二氧化锰和碳酸钙
③用乙醇萃取碘水中的碘:④用蒸发溶剂的方法可以从氯化钠溶液中得到氯化钠的晶体
A. ①和② B. ②和③ C. ③和④ D. ①和④
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
难度: 中等查看答案及解析
-
下列物质的分类正确的是
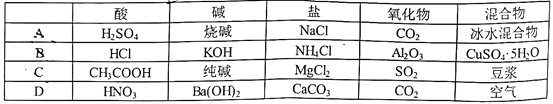
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
同温同压下,相同体积的两种气体A、B的质量比为22:17,若A气体为CO2,则B气体可能是
A. NH3 B. H2S C. SO2 D. O2
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 1mol/L的Na2CO3溶液中含有钠离子约为2×6.02×1023
B. 含氧原子数均为NA的O2和O3的物质的量之比为3:2
C. 每1mol任何物质均含有约为6.02×1023个原子
D. 含氢原子数目相同的NH3和CH4在同温同压下的体积之比为3:4
难度: 中等查看答案及解析
-
实验室需要配制2.0mol/L的NaOH溶液950ml,配制时应选用的容量瓶的规格和称取NaOH的质量分别是
A. 950ml,76.0g B. 500ml,,80g
C. 1000ml,76.0g D. 1000ml,80.0g
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 氧化还原反应的本质是元素化合价发生了改变
B. 物质所含元素化合价降低的反应是氧化反应
C. 有单质参加的化合反应一定是氧化还原反应
D. 还原剂在同一反应中既可以是反应物,也可以是生成物
难度: 中等查看答案及解析
-
下列化学反应中,属于氧化还原反应的是
A. Na2CO3+2HCl=2NaCl+H2O+CO2↑ B. 2 NaHCO3
Na2CO3 + H2O + CO2↑
C. Na2O+H2O=2NaOH D. Zn+H2SO4=ZnSO4 +H2↑
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 二氧化碳与石灰乳的反应:CO2+2OH—=CO32—+H2O
C. 铁粉与硫酸铜溶液反应:Fe+Cu2+=Fe2++Cu
D. 碳酸钙与盐酸反应CO32—+2H+=H2O+CO2↑
难度: 简单查看答案及解析
-
在强酸性溶液中,下列各组离子不能大量共存的是
A. Na+、K+、SO42-、Cl- B. Na+ 、Cl-、SO42-、Fe3+
C. NH4+、K+、CO32-、NO3- D. Ba2+、Na+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列有关胶体的说法中,不正确的是 ( )
A. 向Fe(OH)3胶体中逐滴滴入2 mo l/LNa2SO4有沉淀生成
B. Fe(OH)3胶体在通电后可作定向移动,是因为Fe(OH)3胶体粒子带电
C. 用含0.1 mol FeCl3的饱和溶液制Fe(OH)3胶体时,形成的胶体粒子数目小于0.1NA
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
难度: 简单查看答案及解析
-
根据下列反应判断有关物质的氧化性由强到弱的顺序是
①Cl2+2KBr=2KCl+Br2 ②Br2+H2 SO3+H2O=2HBr+H2SO4
③2KMnO4+16HC1=2KCl+ MnCl2+5Cl2↑+8H2O
A. Cl2>KMnO4>Br2>H2SO4 B. KMnO4>Cl2>H2SO4>Br2
C. KMnO4>Cl2>Br2>H2SO4 D. H2SO4>Br2>Cl2>KnO4
难度: 中等查看答案及解析
-
在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,被氧化和被还原的原子的物质的量之比是
A. 1:6 B. 5:1 C. 6:1 D. 3:1
难度: 困难查看答案及解析
-
物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
难度: 中等查看答案及解析
-
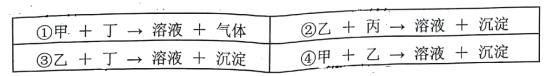
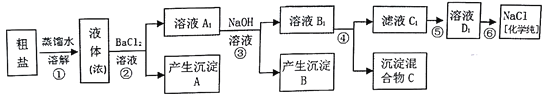
某溶液中可能含有以下离子中的几种:Ba2+、Cl-、NO3-、CO32-、K+、SO42-,为确定其组成,进行了如下实验:①取少量溶液,加入稍过量的BaCl2溶液,产生白色沉淀:②过滤后在沉淀中加入稀盐酸,沉淀部分溶【解析】
③在滤液中加入AgNO3溶液,产生白色沉淀,根据实验,以下推测不正确的是A. 一定含有Cl- B. 一定含有K+
C. 一定含有SO42-和CO32- D. NO3-无法确定是否有
难度: 困难查看答案及解析
-
某溶液中只含有下列四种离子Fe3+、SO42-、Cl-和M离子,经测定Fe3+、SO42-、Cl-和M离子的物质的量之比为2:4:4:3,则M离子可能是下列中的
A. Mg2+ B. Al3+ C. Ba2+ D. Na+
难度: 中等查看答案及解析
-
对反应方程式 NaNO2+NH4Cl=NaCl+N2↑+2H2O的下列说法中,正确的是
A. NaNO2是还原剂,NH4Cl是氧化剂
B. N2既是氧化产物,又是还原产物
C. NaNO2中的氮元素被氧化,发生了氧化反应
D. 每生成1molN2时,转移电子的物质的量为6mol.
难度: 中等查看答案及解析
-
在某两烧杯溶液中,各含有大量以下六种离子Cu2+、OH-、CO32-、Mg2+、K+、NO3-中的三种,已知乙烧杯溶液呈碱性,则甲烧杯溶液中大量存在的离子组是
A. Cu2+、Mg2+、K+ B. Cu2+、Mg2+、NO3-
C. Cu2+、K+、NO3- D. Mg2+、K+、NO3-
难度: 中等查看答案及解析
-
将2×10-3mol的XO42-还原时,恰好用去0.1mol/L的Na2SO3溶液30mL(Na2SO3反应后生成了Na2SO4),则元素X在还原产物中的化合价是
A. +1 B. +2 C. +3 D. +4
难度: 中等查看答案及解析