-
化学与生活生产密切相关。下列说法中,不正确的是
A. 将海水直接电解可获得 Mg及Cl2等单质
B. 把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C. 施用适量石膏可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D. 施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
难度: 困难查看答案及解析
-
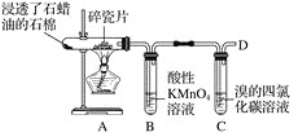
可用来鉴别2-丁烯、四氯化碳、苯的物质或方法是( )
A. 水 B. 液溴 C. 溴水 D. 硝化反应
难度: 中等查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系:2v(A)=3v(B),v(C)=2v(B),则此反应可表示为( )
A. 3A+2B=4C B. 2A+3B=6C C. 3A+2B=C D. 2A+3B=4C
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 碳酸氢钠在水溶液中的电离方程式为:NaHCO3 = Na+ + H+ + CO32-
B. 可溶性盐在水中完全电离是强电解质,难溶性盐在水中溶解度很小是弱电解质
C. 强电解质的水溶液导电性不一定强于弱电解质的水溶液
D. 强电解质都是离子化合物,在水溶液或熔融状态下完全电离,以离子形式存在
难度: 中等查看答案及解析
-
下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2
N2O4平衡体系中充入He后,体系颜色变浅
难度: 困难查看答案及解析
-
为了减缓锌和一定浓度盐酸的反应速率,而又不减少产生氢气的量,向盐酸中加入下列物质或措施可行的是( )
A. 升温 B. NaF溶液 C. NaNO3溶液 D. 几滴CuSO4溶液
难度: 中等查看答案及解析
-
下列实验装置图正确的是()
A.
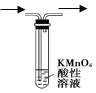 除去甲烷中混有的乙烯
除去甲烷中混有的乙烯B.
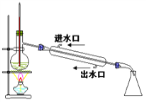 石油分馏
石油分馏C.
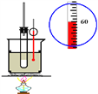 实验室制硝基苯
实验室制硝基苯D.
 实验室制乙炔并检验乙炔
实验室制乙炔并检验乙炔难度: 困难查看答案及解析
-
在初始温度为500 ℃的绝热恒容密闭容器中,充入1 mol HI发生如下反应:2HI(g)
H2(g)+I2(g)。能说明该反应达到平衡的是( )
A. HI的生成速率是I2 消耗速率的2倍
B. 平衡常数不再改变
C. 气体密度不再改变
D. 容器内气体质量不再改变
难度: 困难查看答案及解析
-
下列有关电化学装置完全正确的是( )
A
B
C
D
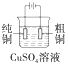
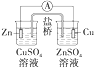
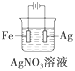
铜的精炼
构成铜锌原电池
铁上镀银
防止Fe被腐蚀
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2O
Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析不正确的是( )
A. 浊液中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq)
B. 实验表明实验室可用氨水洗涤附着有银的试管
C. 由实验可以判断K[Ag(NH3)2+]>KSP(AgCl)
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
难度: 困难查看答案及解析
-
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是( )
A. 溶液中的H+起催化作用 B. 在酸性条件下,亚氯酸钠的氧化性增强
C. ClO2逸出,使反应的生成物浓度降低 D. 溶液中的Cl-起催化作用
难度: 困难查看答案及解析
-
已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-
2Fe2++I2”的是
实验编号
实验操作
实验现象
滴入KSCN溶液
溶液变红色
滴入AgNO3溶液
有黄色沉淀生成
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
滴入淀粉溶液
溶液变蓝色
A. ①和② B. ②和④ C. ③和④ D. ①和③
难度: 简单查看答案及解析
-
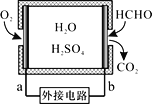
全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
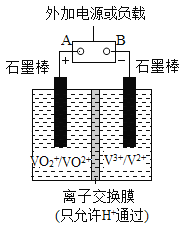
A. 放电时的正极反应为V3++e-=V2+
B. 放电过程中,右槽溶液由紫色变为绿色
C. 充电时的电流方向由B电极流向A电极
D. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
难度: 困难查看答案及解析
-
下列有关烃类物质的说法正确的是( )
A. 石油通过减压分馏可以得到相对分子量较大的芳香烃
B. 丙烯与溴的四氯化碳溶液反应生成1,3-二溴丙烷
C.
 中至少有16个原子共平面
中至少有16个原子共平面D.
的一氯代物的同分异构体有12种
难度: 困难查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4
2NO2 △H > 0)
(a)将两容器置于沸水中加热方
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙(b)甲<乙 B.(a)甲>乙(b)甲=乙
C.(a)甲<乙(b)甲>乙 D.(a)甲>乙(b)甲>乙
难度: 简单查看答案及解析
-
25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/L NaF溶液的pH约为8.2
难度: 中等查看答案及解析