-
《可再生能源法》倡导碳资源的高效转化及循环利用。下列做法与上述理念相违背的是
A. 加快石油等化石燃料的开采和使用 B. 大力发展煤的气化及液化技术
C. 以CO2 为原料生产可降解塑料 D. 将秸秆进行加工转化为乙醇燃料
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 乙酸乙酯的最简式:C4H8O2 B. 丙醛的结构简式:CH3CH2COH
C. 四氯化碳的电子式:
D. 聚乙烯的结构简式:
CH2—CH2
难度: 简单查看答案及解析
-
下列有机物命名正确的是
A.
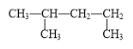 1,3-二甲基丁烷
1,3-二甲基丁烷B.
2-羟基丙烷
C.
3-乙基-1,3-丁二烯
D.
 对硝基甲苯
对硝基甲苯难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 17 g羟基所含有的电子数目为7NA
B. 标准状况下,22.4 L甲醛含有氢原子数为2 NA
C. 1 mol苯甲醛分子中含有的双键数目为4NA
D. 29 g乙烷与乙烯的混合气体含碳原子数目为2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 石油分馏、煤的干馏都是物理变化
B. 苯和甲苯互为同系物,均能使酸性KMnO4溶液褪色
C. 1-氯丙烷和2-氯丙烷互为同分异构体,通过核磁共振氢谱不能鉴别二者
D. 通过红外光谱分析可以区分甲醇与甲酸甲酯
难度: 简单查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是
①焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g) ΔH1 = 131.3 kJ·mol–1
②太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH2 = 571.6 kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH3 = 206.1 kJ·mol–1
A. 反应①为放热反应
B. 反应②中电能转化为化学能
C. 若反应③使用催化剂,ΔH3不变
D. 反应2H2(g) + O2(g) = 2H2O(g)的ΔH = -571.6 kJ·mol–1
难度: 简单查看答案及解析
-
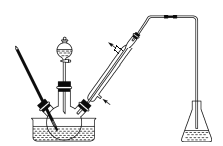
用下图所示装置进行实验,其中合理的是
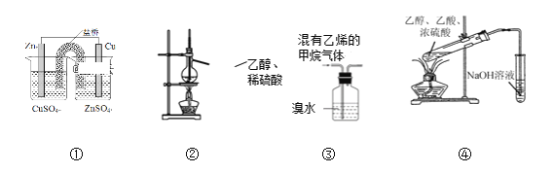
A. 装置①能将化学能转化为电能
B. 装置②可用于实验室制乙烯
C. 装置③可除去甲烷中的乙烯
D. 装置④可用于实验室制乙酸乙酯
难度: 中等查看答案及解析
-
下列与电化学有关的说法正确的是
A. 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B. 铅蓄电池在充电过程中,两极质量都增大
C. 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀
D. 电解精炼铜的过程中,阳极减少的质量一定等于阴极增加的质量
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:
+H2O+CO2→
+
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+
+2OH-
CH3COONH4+H2O+2Ag↓+3NH3↑
难度: 中等查看答案及解析
-
已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑。测得c(FeO42-)在不同条件下变化如图甲、乙、丙、丁所示。
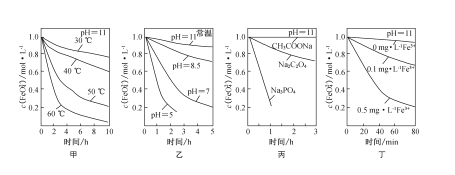
下列说法不正确的是
A. 图甲表明,其他条件相同时,温度越高FeO42-反应速率越快
B. 图乙表明,其他条件相同时,溶液碱性越强FeO42-反应速率越慢
C. 图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D. 图丁表明,其他条件相同时,pH=11条件下加入Fe3+能加快FeO42-的反应速率
难度: 困难查看答案及解析
-
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法正确的是
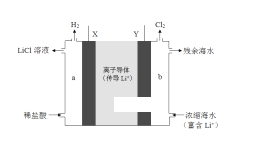
A. 电子由X极通过外电路移向Y极
B. 电池工作时,Li+通过离子导体移向b区
C. 负极发生的反应为:2H++2e-=H2↑
D. Y极每生成1 mol Cl2,a区得到2 mol LiCl
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
实验结论
A
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜
蔗糖未水解
B
卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀
说明卤代烃Y中含有氯原子
C
向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生
说明苯酚的酸性强于碳酸
D
向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊
蛋白质发生了盐析
A. A B. B C. C D. D
难度: 中等查看答案及解析
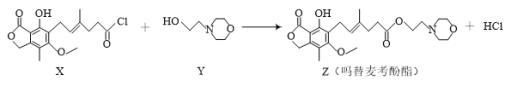

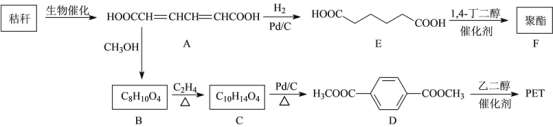
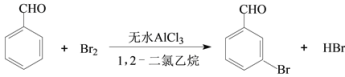
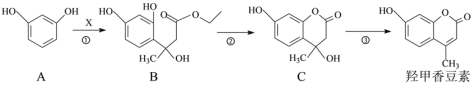
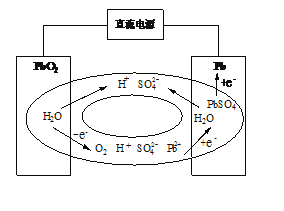
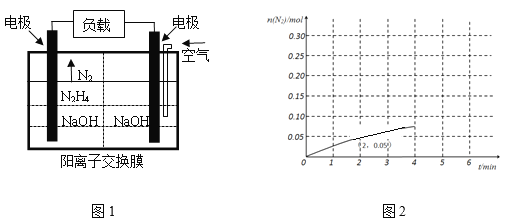
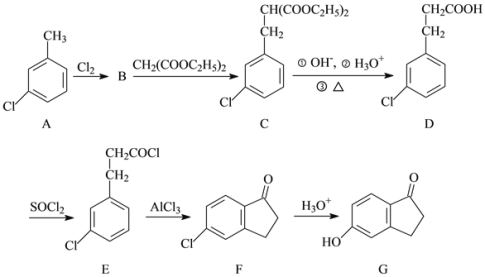
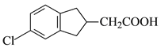 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。