-
一些装有化学物质的车辆常贴有危险化学品的标志。下列标志中,应贴在装有汽油的运输车辆上的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
合金是一类用途广泛的金属材料。下列物质中,不属于合金的是( )
A. 不锈钢 B. 青铜 C. 硬铝 D. 水银
难度: 简单查看答案及解析
-
下列化学物质在实际生产、生活和科技等方面的叙述正确的是( )
A. 二氧化硅是太阳能电池的主要材料
B. SO2、漂白粉、活性炭、Na2O2都能使品红溶液褪色,其原理相同
C. 在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质
D. 某雨水样品放置一段时间后,酸性增强,是因为溶解了CO2
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B. 向FeCl3溶液中加入几滴KSCN溶液:3SCN-+Fe3+ =Fe(SCN)3 ↓
C. 稀硫酸和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
D. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,22.4 L SO3含有的分子数为NA
B. 1mol氯气与足量铁粉充分反应,转移的电子数为3NA
C. 16 g O2和O3的混合气体中含氧原子数目为NA
D. 1mol/LNa2CO3溶液中含有Na+数目为2NA
难度: 中等查看答案及解析
-
“分类”是一种思想方法,在化学发展中起到了重要的作用。下列说法正确的是( )
A. Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
B. 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
C. 只有溶于水能够导电的化合物才是电解质
D. 冰和干冰既是纯净物又是化合物
难度: 中等查看答案及解析
-
下列各组离子,在酸性溶液中能大量共存,且溶液为无色透明的是( )
A. K+、MnO4-、Cl- 、SO42- B. Na+、Ba2+、NO3-、OH-
C. Na+、CO32-、Al3+、Cl- D. Na+、Mg2+、NO3-、SO42-
难度: 中等查看答案及解析
-
下表是各物质及其所含的少量杂质,以及除去这些杂质所选用的试剂或操作方法,其中不正确的是( )
选项
物质
杂质
除杂试剂或操作方法
A
FeCl2溶液
FeCl3
加入过量铁粉,再过滤
B
NaHCO3溶液
Na2CO3
通入过量的CO2气体
C
NaNO3溶液
Na2SO4
加入适量的BaCl2溶液,再过滤
D
MgO固体
Al2O3
加入过量的NaOH溶液,再过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法中不正确的是( )
A. 漂白粉开口放置于空气中容易变质
B. 氯水是比漂白粉、漂白液更稳定的漂白剂
C. 漂白液的有效成分是NaClO
D. 工业上制漂白粉的方法是:将氯气通入石灰乳制取漂白粉
难度: 中等查看答案及解析
-
标准状况下,有①0.112L水;②3.01×1023个氯化氢分子;③13.6gH2S气体;④0.2mol氨气。下列对这四种物质的关系由小到大排列正确的是( )
A. 氢原子数:①③④② B. 密度:④①③②
C. 质量:①④③② D. 体积:①④③②
难度: 困难查看答案及解析
-
有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是( )
A. 氨水 B. 盐酸 C. Na2SO4溶液 D. KSCN溶液
难度: 中等查看答案及解析
-
下列有关离子(或物质)的检验、现象及结论,都正确的是( )
A. 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色,该溶液中一定含有Fe2+
B. 焰色反应实验中,透过蓝色钴玻璃,可观察到钠离子火焰呈黄色
C. 向FeCl2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄,说明发生氧化还原反应,且氧化性:H2O2>Fe3+
D. 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42﹣
难度: 中等查看答案及解析
-
在同温同压下,将充有等体积混合而成的四组气体:①NO2+O2;②NO2+NO;③HCl+N2;④SO2+O2,分别通入体积相同的试管,并立即倒立于水槽中,如图所示,待试管内液面稳定后,剩余气体体积依次V1、V2、V3、V4,则剩余气体体积最多的是( )
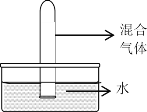
A. V1 B. V2 C. V3 D. V4
难度: 困难查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42- 及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是( )
①加适量盐酸 ②过滤 ③加过量Na2CO3溶液
④加过量NaOH溶液 ⑤加过量BaCl2溶液
A. ⑤④③②① B. ⑤④③①② C. ②⑤④③① D. ③⑤④②①
难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比是( )
A. 5:4 B. 5:3 C. 4:5 D. 3:5
难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe2O3的混合物中,加入500 mL 1 mol/L的盐酸,恰好使混合物完全溶解,放出672 mL(标准状况)气体。向所得溶液中加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能得到铁( )
A. 28 g B. 14 g
C. 12.32 g D. 条件不足,无法计算
难度: 中等查看答案及解析