-
人们将化合物分为电解质和非电解质两类,下列属于电解质的是
A. 氯气 B. 金属铝 C. 氯化钠 D. 汽油
难度: 简单查看答案及解析
-
下列相关反应的离子方程式书写正确的是
A. 氢氧化钡溶液和稀硫酸反应:Ba2++SO42﹣═BaSO4↓
B. 碳酸钙和醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO32-═HCO3-
难度: 中等查看答案及解析
-
下列关于氮的氧化物的说法中,正确的是
A. 氮的氧化物都是酸性氧化物
B. 氮的氧化物都既有氧化性,又有还原性
C. NO2 与 H2O 反应生成 HNO3,所以 NO2 是酸性氧化物
D. NO 和 NO2 均有毒
难度: 简单查看答案及解析
-
下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是
A. 向漂白粉浊液中通入过量的CO2
B. 向带有氧化膜的铝片中加入盐酸
C. 向含有1molCa(HCO3)2的溶液中加入1molNa2O2
D. 向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2
难度: 中等查看答案及解析
-
浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
A. BaCl2 NaOH NaHCO3 B. Na2CO3 MgCl2 H2SO4
C. AlCl3 NH3·H2O NaOH D. Ba(OH)2 CaCl2 Na2SO4
难度: 中等查看答案及解析
-
下列溶液中的离子—定能大量共存的是( )
A. 含大量 MnO4-的溶液中:Na+、K+、Cu2+、Fe3+
B. 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C. 酸性溶液中:Ba2+、NO3-、K+、AlO2-
D. 含大量 Fe3+的溶液中:NH4+、Na+、I-、SCN-
难度: 困难查看答案及解析
-
下列物质中,不属于合金的是( )
A. 青铜 B. 不锈钢 C. 水银 D. 硬铝
难度: 简单查看答案及解析
-
下列物质与常用危险化学品的分类不对应的是( )
A. Na——遇湿易燃物品 B. Na2O2——氧化剂
C. 浓硫酸——易爆品 D. KOH——腐蚀品
难度: 简单查看答案及解析
-
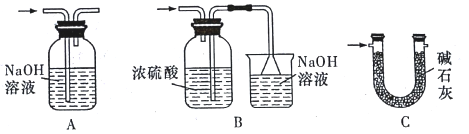
下列实验不合理的是

A. 用浓硫酸干燥SO2,选③
B. 从食盐溶液中获取NaCl,选②
C. 除去自来水中的Cl-,制纯净水,选④和①
D. 除去Fe(OH)3胶体中的难溶物,选④
难度: 简单查看答案及解析
-
下列解释不科学的是
A. 高压氧舱可治疗煤气中毒,原因是和血红蛋白结合的 CO 跟氧气反应生成无毒的 CO2
B. 在溶洞中当溶有 Ca(HCO3)2 水溶液,析出固体(在洞顶或洞底),日久天长便形成了钟乳石
C. 氮是植物体内蛋白质、核酸和叶绿素的组成元素
D. “通风橱”利用排风扇将橱内废气直接排放到室外,它是一种不完善的防污措施
难度: 简单查看答案及解析
-
下列关于物质的量浓度表述正确的是
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1mol•L-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1mol•L-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
难度: 困难查看答案及解析
-
用 NA 表示阿伏加德罗常数的数值,下列说法正确的是
A. 1 mol Cl2 与足量的铁反应转移的电子数是 2NA
B. 常温常压下 22.4 L HC1 气体含有的分子数是NA
C. 0.1 mol • L-1 CuCl2 溶液中 Cl-数目是 0.2 NA
D. 32 gO2 中含有的原子数是NA
难度: 中等查看答案及解析
-
下列表述不正确的是
A. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是 Al2O3
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红.可用作油漆、红色涂料
D. 分散系中分散质粒子的直径:Fe(OH)3 悬浊液> Fe(OH)3 胶体>FeCl3 溶液
难度: 中等查看答案及解析
-
下列物质不能由单质直接化合生成的是
A. NO B. Na2O C. SO2 D. FeCl2
难度: 简单查看答案及解析
-
下列反应中,水只作氧化剂的氧化还原反应是
A. 3Fe+4H2O(g)
Fe3O4+4H2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2F2+2H2O=4HF+O2 D. Cl2 + H2O ⇌ HCl + HClO
难度: 简单查看答案及解析
-
下列各组物质反应时,改变反应条件或者反应物的物质的量之比,生成的产物不变的是( )
A.Na与氧气 B.澄清石灰水与二氧化碳
C.氯化铝溶液与氢氧化钠溶液 D.Al与稀盐酸
难度: 中等查看答案及解析
-
下列溶液中能够区别 SO2 和 CO2 气体的是
①澄清石灰水 ②H2S 溶液 ③KMnO4 酸性溶液 ④氯水 ⑤品红溶液
A. ①②③ B. ②③④ C. 除①以外 D. 全部
难度: 中等查看答案及解析
-
下列各组反应,最终一定能得到白色沉淀的是
A. 向Al2(SO4)3溶液中加入过量NaOH溶液 B. 向CuSO4溶液中加入NaOH溶液
C. 向FeCl2溶液中加入过量NaOH溶液 D. 向Na2SiO3溶液中加入稀盐酸
难度: 简单查看答案及解析
-
高铁酸钠 (Na2FeO4)是一种高效的饮用水处理剂,可由下列方法制得:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 关于该反应,下列说法正确的是
A. Fe(OH)3 中铁元素化合价为+3,只有氧化性
B. 反应中 NaClO 是氧化剂,NaCl 是氧化产物
C. 反应中每生成1 mol Na2FeO4,转移6 mol电子
D. Na2FeO4 具有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 向含有 CaCO3沉淀的水中通入足量的CO2,沉淀不会溶解
B. 向 Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原 Na2CO3的物质的量之比为1:1
C. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积不相同
D. 分别向NaHCO3溶液和Na2CO3溶液中加入 Ca(OH)2溶液,只有Na2CO3溶液产生沉淀
难度: 中等查看答案及解析
-
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
难度: 中等查看答案及解析