-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
关于电解法精炼铜的下列说法正确的是( )
A. 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液
B. 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液
C. 电解结束后,溶液中Cu2+浓度不变
D. 电解结束后,溶液中Cu2+浓度变大
难度: 简单查看答案及解析
-
下列关于燃烧热的说法中正确的是
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
难度: 中等查看答案及解析
-
下列措施不能增大反应速率的是 ( )
A. 升高温度 B. 降低温度
C. 提高反应物浓度 D. 使用合适的催化剂
难度: 简单查看答案及解析
-
在2A+B===3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5 mol·L-1·s-1
B. v(B)=0.3 mol·L-1·s-1
C. v(C)=0.8 mol·L-1·s-1
D. v(D)=1.0 mol·L-1·s-1
难度: 简单查看答案及解析
-
对原电池的电极名称,下列叙述中错误的是( )
A. 电子流入的一极为正极 B. 比较不活泼的一极为正极
C. 电子流出的一极为负极 D. 发生氧化反应的一极为正极
难度: 中等查看答案及解析
-
下列过程需要通电后才可以发生或进行的是
①电离 ②电泳 ③电解 ④电镀 ⑤电化学腐蚀
A. ①② B. ②③④ C. ②③④⑤ D. 全部
难度: 中等查看答案及解析
-
现向一密闭容器中充入1 molN2和3 molH2,在一定条件下发生反应:N2+3H2
2NH3,下列有关说法正确的是
A. 达到化学平衡时,N2将完全转化为氨
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
难度: 中等查看答案及解析
-
下列反应中是放热反应的是
A. 二氧化碳与碳反应生成一氧化碳 B. 碳与水蒸气反应生成一氧化碳和氢气
C. 碳酸钙受热分解 D. 盐酸与氢氧化钠反应
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C. 放热反应都不需要加热就能发生
D. 吸热反应在一定条件(如常温、加热等)下也能发生
难度: 简单查看答案及解析
-
已知反应A+3B=2C+D在一分钟内A的物质的量浓度由2mol/L降为1mol/L,C的平均反应速率为
A. 1mol/(L·s) B. 3 mol/(L·min)
C. 4mol/(L·s) D. 2mol/(L·min)
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 焓变是指1 mol物质参加反应时放出的能量
B. 反应放热时,ΔH>0;反应吸热时,ΔH<0
C. 在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D. 在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
难度: 中等查看答案及解析
-
下图所表示的反应是吸热反应的是
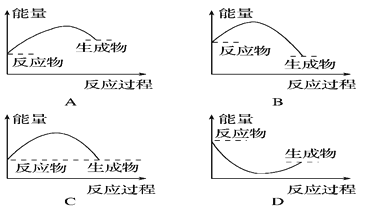
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列热化学方程式中书写正确的是
A. 2SO2+O2
2SO3 ΔH = −196.6 kJ/mol
B. H2(g)+
O2(g)
H2O(l) ΔH = −285.8 kJ/mol
C. 2H2(g)+O2(g)
2H2O(l) ΔH = −571.6 kJ
D. C(s)+O2(g)
CO2(g) ΔH = +393.5 kJ/mol
难度: 中等查看答案及解析
-
热化学方程式C(s)+H2O(g)
CO(g)+H2(g) △H=+131.3 kJ·mol-1表示 ( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3KJ 热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加
B. 对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C. 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率
D. 对于本来不能发生的化学反应,改变条件可以使反应发生
难度: 中等查看答案及解析
-
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是
A. 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B. 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C. 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D. 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
难度: 中等查看答案及解析
-
设C+CO2
2CO ΔH>0,反应速率为v1,N2+3H2
2NH3 ΔH<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A. 同时增大 B. 同时减小 C. 增大,减小 D. 减小,增大
难度: 简单查看答案及解析
-
下列哪些是影响化学反应速率的主要因素( )
A.压强 B.温度 C.催化剂 D.反应物的性质
难度: 简单查看答案及解析
-
用3 g块状大理石与30 mL 3 mol·L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是
①再加入30 mL 3 mol·L-1盐酸 ②改用30 mL 6 mol·L-1盐酸 ③改用3 g粉末状大理石
A. ①② B. ②③ C. ①③ D. ①②③
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,含微粒种类最多的是
A. CaCl2 B. CH3COONa
C. NH3 D. Na2S
难度: 中等查看答案及解析
-
下列说法正确的是
A. 增大反应物的量,化学反应速率一定加快
B. 升高温度可使放热反应的速率减慢,吸热反应的速率加快
C. 增大压强,化学反应速率一定加快
D. 使用催化剂能加快反应速率
难度: 中等查看答案及解析
-
反应:A(气)+3B(气)
2C(气); ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A. 正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B. 正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C. 正反应速率和逆反应速率都变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率都变小,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
对于工业合成氨反应:N2+3H2
2NH3,下列说法错误的是( )
A. 使用合适的催化剂可以加大反应速率 B. 升高温度可以增大反应速率
C. 增大N2浓度可以使H2转化率达到100℅ D. 增大N2浓度可以增大反应速率
难度: 中等查看答案及解析
-
铜锌原电池(如图所示)工作时,下列叙述正确的是:
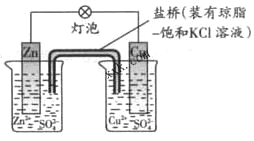
A. 正极反应是:Zn – 2e -= Zn2+
B. 电池反应是:Zn + Cu2+= Zn2+ + Cu
C. 在外电路中电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
难度: 简单查看答案及解析
-
化学平衡常数可以用 K 来表示,下列关于 K 的说法中正确的是( )
A. K 越大,反应物的转化率越小
B. K 与温度一定有关
C. K 与生成物的浓度一定有关
D. K 与反应物的浓度一定有关
难度: 中等查看答案及解析
-
下列各项关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上镀铜时可用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
难度: 中等查看答案及解析
-
有如图装置,下列有关该装置的叙述正确的是( )

A. 锌极附近滴入酚酞,溶液呈红色。
B. 铁极发生的电极反应为:2H2O+O2+4e=4OH-
C. 铁极发生了吸氧腐蚀
D. 溶液中的OH-离子向铁极移动
难度: 简单查看答案及解析
-
下列叙述的方法不正确的是
A. 金属的电化学腐蚀比化学腐蚀更普遍 B. 用铝质铆钉铆接铁板,铁板易被腐蚀
C. 钢铁在干燥空气中不易被腐蚀 D. 用牺牲锌块的方法来保护船身
难度: 中等查看答案及解析
-
根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( )
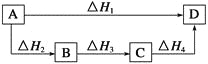
A. ΔH1=ΔH2=ΔH3=ΔH4 B. ΔH1+ΔH2=ΔH3+ΔH4
C. ΔH1+ΔH2+ΔH3=ΔH4 D. ΔH1=ΔH2+ΔH3+ΔH4
难度: 中等查看答案及解析

