-
下列实验操作中,错误的是
A. 蒸发操作时,不能使混合物中的水分完全蒸干后,才停止加热
B. 蒸馏操作时,应使温度计水银球与蒸馏烧瓶的支管口处相平
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
下列说法正确的是
A. 二氧化硫和漂白粉都具有漂白作用,它们都能使溴水和高锰酸钾溶液褪色
B. 过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C. 二氧化硫和氯气都具有漂白作用,它们都能使石蕊试液先变红色再褪色
D. 盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
难度: 简单查看答案及解析
-
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
难度: 中等查看答案及解析
-
某同学用Na2CO3固体配制0.10 mol/LNa2CO3溶液的过程如下图所示。你认为该同学的错误有
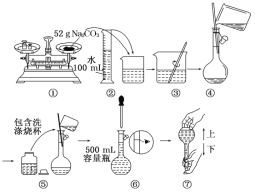
A. ①⑤⑥ B. ①⑥⑦ C. ②④⑦ D. ⑤⑥⑦
难度: 简单查看答案及解析
-
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol·L-1,c(Mg2+)=0.25mol·L-1,c(Cl-)=0.20mol·L-1,则c(SO42-)为
A.0.15mol·L-1 B.0.10mol·L-1 C.0.25mol·L-1 D.0.20mol·L-1
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段。下列分类结论正确的是
①氨水、氢氧化铝、冰醋酸、氟化氢都是弱电解质 ②HClO、浓硫酸、HNO3均具有强氧化性,都是氧化性酸 ③HI、Na2O2、胆矾都是电解质 ④SiO2、CO2、SO2都是是酸性氧化物,所以它们都能够与水反应生成相应的酸 ⑤漂粉精、氯水、水玻璃、水银都是混合物
A. ①②④ B. ② C. ②③ D. ②③④⑤
难度: 简单查看答案及解析
-
磷中毒可用硫酸铜解毒,反应方程式为:11P+15CuSO4+24H2O=Cu3P+6H3PO4+15H2SO4分析反应,下列说法错误的是
A.P既是氯化剂又是还原剂
B.Cu3P既是氧化产物又是还原产物
C.CuSO4发生了还原反应
D.当生成lmol Cu3P时,转移电子的物质的量为6 mol
难度: 中等查看答案及解析
-
下列说法不正确的是
A. APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品
B. 兰州某些时段实行机动车辆限牌限行政策,目的是为了减少SO2、氮氧化物等有害物的排放,以及减少雾霾带来的危害
C. 工业上用FeCl3溶液来腐蚀铜膜,制作印刷电路板
D. 硅是人类将太阳能转变为电能的常用材料
难度: 简单查看答案及解析
-
符合如下实验过程和现象的试剂组是( )
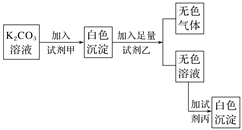
选项
甲
乙
丙
A
MgCl2
HNO3
K2SO4
B
BaCl2
HNO3
K2SO4
C
NaNO3
H2SO4
Ba(NO3)2
D
BaCl2
HCl
CaCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关实验的说法正确的是
A. 除去氧化铁中混有的少量氧化铝,可加入过量的氢氧化钠溶液,完全反应后,过滤
B. 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C. 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D. 可用澄清石灰水和盐酸鉴别Na2CO3溶液和Na2SO3溶液
难度: 中等查看答案及解析
-
饱和氯水长期放置后,下列微粒在溶液中不减少的是
A.HClO B.Cl— C.Cl2 D.ClO—
难度: 简单查看答案及解析
-
工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物﹣﹣合金.这是制取合金的常用方法之一.根据下表数据判断,不宜用上述方法制取合金的是( )
金属
Na
Al
Cu
Fe
熔点(℃)
97.81
660
1083
1535
沸点(℃)
883
2200
2595
3000
A. Fe﹣Cu合金 B. Cu﹣Al合金 C. Al﹣Na合金 D. Cu﹣Na合金
难度: 困难查看答案及解析
-
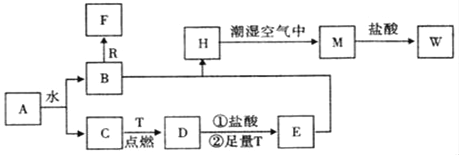
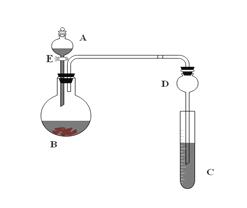
现有如下所示4个装置图,以下说法中正确的是
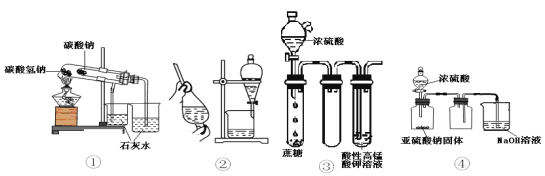
A. ①装置可用于比较NaHCO3和Na2CO3的稳定性 B. 用酒精萃取溴水中的溴可选择②装置
C. 如③装置进行实验可看到酸性KMnO4溶液褪色 D. ④装置可用于实验室制取并收集少量SO2
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3- +2OH-=CaCO3↓+CO32-+H2O
B. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C. 将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
①常温下pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
②加入铝粉能放出H2的溶液中:NH4+、Fe2+、NO3-、SO42-
③无色透明酸性溶液中:MnO4- 、K+、Al3+、SO42-
④含有大量Fe3+的溶液中:Na+、Mg2+、Cl-、SCN-
A. ①② B. ①③④ C. ① D. ②③
难度: 中等查看答案及解析
-
工业上将氨气和空气的混合气体通过铂—铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
将盛有1 mol NO和NO2混合气体的试管倒立于盛满水的水槽中,再通入0.4 mol O2,充分反应后,整个试管充满水。则原混合气体中NO与NO2体积比为( )
A. 1:2 B. 3:7 C. 2:5 D. 无法确定
难度: 简单查看答案及解析
-
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
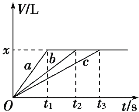
A. x=2.24 B. 曲线b为Mg与盐酸反应的图象
C. 反应时,Na、Mg、Al均过量 D. 钠的物质的量为0.2 mol
难度: 中等查看答案及解析
-
把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后溶液中大量存在的金属阳离子是
A. 只有Fe2+ B. 只有Fe3+ C. 有Fe2+和Cu2+ D. 有Fe3+和Cu2+
难度: 简单查看答案及解析
-
有一粗硅,含铁和硅两种成分,取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的氢气,则该粗硅中铁和硅的关系正确的是
①物质的量之比为1∶1 ②物质的量之比为2∶1 ③质量之比为4∶1 ④质量之比为2∶1
A. ①③ B. ①④ C. ②③ D. ②④
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是:
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
难度: 简单查看答案及解析
-
对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
难度: 困难查看答案及解析