-
下列说法正确的是( )
A. 硫完全燃烧生成二氧化硫时,放出的热量为硫的燃烧热
B. 在25 ℃、101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C. 由2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,可知CO的燃烧热为283 kJ·mol-1
D. 乙炔的燃烧热为-1 299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)反应的ΔH=-2 599.2 kJ·mol-1
难度: 简单查看答案及解析
-
将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+3Y(g) ⇌ 2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是
A. 升高温度,X的体积分数减小
B. 缩小体积,Y的物质的量浓度不变
C. 保持容器体积不变,充入一定量的稀有气体,Z的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
难度: 中等查看答案及解析
-
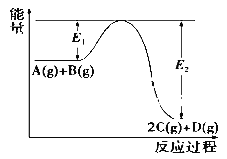
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
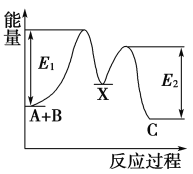
A. E2表示反应X→C的活化能
B. X是反应A+B→C的催化剂
C. 反应A+B→C的ΔH<0
D. 加入催化剂可改变反应A+B→C的焓变
难度: 中等查看答案及解析
-
化学反应可视为旧键短裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H-H 键的键能为436kJ·mol-1,Cl-Cl键的键能为243 kJ·mol-1,H-Cl键的键能为431 kJ·mol-1,则H2(g ) + Cl2 (g ) ="=" 2HCl(g ) 的反应热(△H )等于
A. -183 kJ·mol-1 B. 183 kJ·mol-1 C. -862 kJ·mol-1 D. 862 kJ·mol-1
难度: 中等查看答案及解析
-
燃烧1 g乙炔生成二氧化碳和液态水放出热量50 kJ,则下列热化学方程式书写正确的是( )
A. 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=+50 kJ·mol-1
B. C2H2(g)+
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ
C. 2C2H2+5O2===4CO2+2H2O ΔH=-2 600 kJ
D. 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2600 kJ·mol-1
难度: 中等查看答案及解析
-
心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2(s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2(g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2(g) =" 2" I2(s) + 2 Li2O(s) ΔH2则下列说法正确的是( )
A. ΔH=1/2ΔH1 -ΔH2 B. ΔH=1/2ΔH1 +ΔH2
C. ΔH=1/2ΔH1 -1/2ΔH2 D. ΔH=1/2ΔH1 +1/2ΔH2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 所有的放热反应都能在常温常压下自发进行
B. Ba(OH)2·8H2O与NH4Cl反应属放热反应
C. 天然气燃烧时,其化学能全部转化为热能
D. 反应热只与反应体系的始态和终态有关,而与反应的途径无关
难度: 简单查看答案及解析
-
下列条件一定能使反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积
④加入生成物 ⑤加入MnO2
A. 全部 B. ①②⑤ C. ② D. ②③
难度: 简单查看答案及解析
-
已知:4NH3 (g)+5O2 (g)
4NO (g)+6H2O (g) ΔH=-1 025kJ/mol,该反应是一个可逆反应,若反应起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
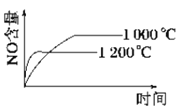 B.
B. 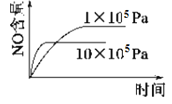 C.
C. 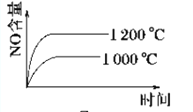 D.
D. 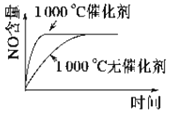
难度: 简单查看答案及解析
-
下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制
二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 简单查看答案及解析
-
邻甲基苯甲酸(
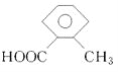 )有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有( )A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向0.1 L 0.2 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀盐酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1<ΔH3<ΔH2
难度: 中等查看答案及解析
-
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A.
 B.
B. 
C.
 D.
D. 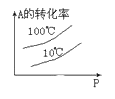
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),达到平衡时,测得A的浓度为0.5 mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A. x+y<z B. 平衡向正反应方向移动
C. C的体积分数下降 D. B的浓度增大
难度: 困难查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K不变,平衡可能移动
B. 平衡移动,K值可能不变
C. 相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍
D. K值变化,平衡一定移动
难度: 中等查看答案及解析
-
在一定温度下某恒容容器中,当下列物理量不再发生变化时,能表明反应A(g)+2B(g)
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤
C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
难度: 简单查看答案及解析
-
乙酸苯甲酯可作茉莉、白兰、月下香等香精的调和香料。它可以用甲苯和乙醇为原料进行人工合成。合成路线如下:
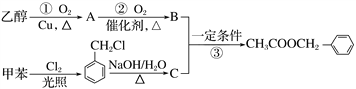
下列说法错误的是
A. 反应②③的反应类型为氧化反应、取代反应
B. 甲苯的一氯代物有4种
C. 有机物C能发生氧化反应、取代反应、消去反应
D. 加入过量的有机物B可以提高有机物C的转化率
难度: 简单查看答案及解析
-
已知下列反应的平衡常数: H2(g)+S(s)
H2S(g) K1 S(s)+O2(g)
SO2(g) K2则反应H2+SO2
O2+H2S的平衡常数为( )
A. K1+K2 B. K1-K2
C. K1×K2 D. K1/K2
难度: 中等查看答案及解析
-
高温、催化剂条件下,某反应达到平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 该反应为吸热反应 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO+H2O(g)
CO2+H2
难度: 中等查看答案及解析
-
如图所示的曲线是表示其他条件一定时,2NO+O2
2NO2(该反应放热)反应中NO的转化率与温度的关系曲线,图中标有A、B、C、D四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
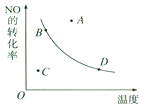
A. A点 B. B点 C. C点 D. D点
难度: 困难查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
难度: 简单查看答案及解析
-
在一定温度下,反应
H2(g)+
X2(g)⇌HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A. 5% B. 17% C. 25% D. 33%
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是( )
A. 生成物总能量一定低于反应物总能量
B. 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质
X
Y
Z
初始物质的量(mol)
0.2
0.2
0
平衡物质的量(mol)
0.1
0.05
0.1
下列说法正确的是( )
A. 反应可表示为2X+3Y
2Z,其平衡常数为8 000
B. 增大压强使平衡向生成Z的方向移动,平衡常数增大
C. 若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D. 若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率 减小,平衡向正反应方向移动
难度: 中等查看答案及解析
-
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
难度: 中等查看答案及解析