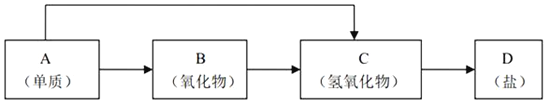
-
标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达不正确的是
A. 体积②>③>①>④
B. 密度②>③>④>①
C. 质量②>③>①>④
D. 氢原子个数①>④>③>②
难度: 中等查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
A. 金刚石属于非金属单质
B. 制造过程中元素种类发生改变
C. CCl4是一种化合物
D. 这个反应是置换反应
难度: 中等查看答案及解析
-
查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质,以及金属钠跟水反应的异同点,下列研究方法中没有用到的是
A. 实验法 B. 观察法 C. 分类法 D. 比较法
难度: 中等查看答案及解析
-
下列有关化学基本概念的判断不正确的是
①具有氧化性的物质在反应中一定做氧化剂
②根据是否仅含一种元素将物质分为纯净物与混合物
③氧化还原反应的本质是反应前后元素化合价变化
④强电解质与弱电解质本质区别是水溶液中导电性强弱
⑤根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑥MgO、Na2O2、CuO、Al2O3都是金属氧化物,也是碱性氧化物.
A. ①②④ B. ③⑤⑥ C. ④⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10—9m)恢复了磁性,其结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
D. 在分散系中,“钴酞菁”分子直径比Na+的直径小
难度: 中等查看答案及解析
-
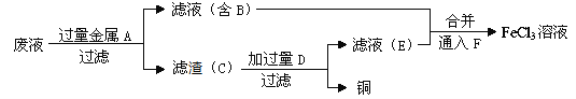
以下实验操作过程中,溶液里无固体物质析出的是( )
A. 向CuCl2溶液中加入钠的小颗粒 B. 向Fe2(SO4)3溶液中加入少量铜粉
C. 向Mg(NO3)2溶液中加入Na2O2粉末 D. 向Fe(OH)3胶体中逐滴加稀硫酸
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 漂白粉溶液漂白的原理是与空气中的CO2反应生成次氯酸
B. 84消毒液的主要成分是次氯酸钠
C. 金属钠保存在煤油中
D. 久置氯水酸性会减弱
难度: 中等查看答案及解析
-
表示阿伏加德罗常数,下列叙述正确的是
A. 在
mol/L 的AlCl3 溶液中,含有Cl- 个数为
B. 56g铁粉与标况下
氯气充分反应,转移电子数
C. 通常状况下,
个CO2分子占有的体积为
L
D.
所含的电子数为
个
难度: 中等查看答案及解析
-
若30g密度为d
的
溶液中含有
不考虑
与水反应
,则Cl-的浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50mL1mol/L的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A. 75mL3mol/L的NH4Cl B. 150mL1mol/L的NaCl
C. 50mL1.5mol/L的CaCl2 D. 50mL3mol/L的NaClO
难度: 中等查看答案及解析
-
在碱性溶液中能大量共存且为无色透明溶液的是
A. K+、Cl-、MnO4-、SO42- B. Na+、SO42-、Cl-、NO3-
C. H+、NO3-、SO42-、Mg2+ D. Na+、Cu2+、NO3-、CO32-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. Cl2与水反应:Cl2+H2O=2H++Cl-+ClO-
B. 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-= H2O+BaSO4↓
C. 碳酸钙与醋酸溶液反应:CaCO3+2H+ =Ca2++H2O+CO2↑
D. 澄清石灰水中加入碳酸钠溶液:Ca2++CO32-=CaCO3↓
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A. 含金属元素的离子一定都是阳离子
B. 金属阳离子被还原不一定得到金属单质
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 在氧化还原反应中,非金属单质一定是氧化剂
难度: 中等查看答案及解析
-
检验氯化氢气体中是否混有氯气,可采用的方法是
A. 用干燥的蓝色石蕊试纸 B. 用湿润的红色布条
C. 将气体通入硝酸银溶液中 D. 用干燥有色布条
难度: 中等查看答案及解析
-
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1 mol N2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是
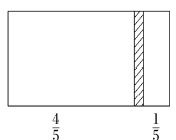
A. 右边与左边分子数之比为4∶1
B. 右侧CO的质量为5.6 g
C. 右侧气体密度是相同条件下氢气密度的14倍
D. 若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2 mol CO
难度: 中等查看答案及解析
-
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
难度: 中等查看答案及解析