-
化学无处不在,下列有关说法不正确的是
A. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
B. 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C. 碘是人体必须的微量元素,所以每个人都要补碘
D. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124g P4中所含P—P键数目为4NA
B. 1 mol Fe溶于过量硝酸,电子转移数为2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为4NA
D. 密闭容器中,2 mol SO2和1mol O2催化反应后原子总数为8NA
难度: 中等查看答案及解析
-
下列各离子组能大量共存的是
A. 澄清溶液中:Cu2+、NH4+、C1-、SO42-
B. 常温下pH=1的溶液中:NO3-、K+、Na+、I-
C. 在1mol·L-1的KMnO4酸性溶液中:K+、SO32-、SO42-、C1-
D. 0.1mol/L的A1C13溶液中:Na+、HCO3-、NO3-、Fe2+
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和乙三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
A. W、X、Y、Z的简单离子的半径依次增大
B. X的简单氢化物的热稳定性比W的强
C. 析出的黄色沉淀易溶于乙醇
D. X与Z属于同一主族,X与Y属于同一周期
难度: 中等查看答案及解析
-
下列实验的现象和原因都正确的是
实验
现象
原因
A
金属铝与少量氢氧化钠溶液反应
有白色氢氧化铝沉淀生成
氢氧化钠溶液量不足
B
金属铜加入浓硝酸中
产生使品红褪色的气体
生成SO2
C
将洁净的铜丝插入高温硫蒸气中
红色铜丝变黑
生成Cu2S
D
向碳酸钠固体上滴加少量盐酸
无气体产生
生成碳酸氢钠
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
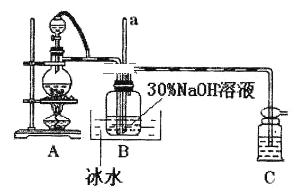
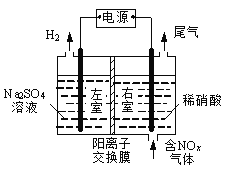
KIO3可采用电解法制备,装置如图所示。下列叙述正确的是
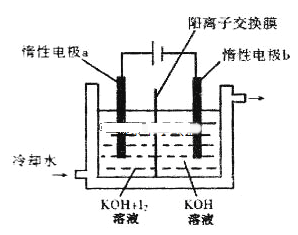
A. 通电后阴极的电极反应式2H2O+2e-=2OH-+H2↑
B. 电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是从右到左
C. 电解过程中阳极附近pH增大
D. 当电路中通过1mol电子的电量时,会有0.5mol的KIO3生成
难度: 中等查看答案及解析
-
CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
难度: 中等查看答案及解析