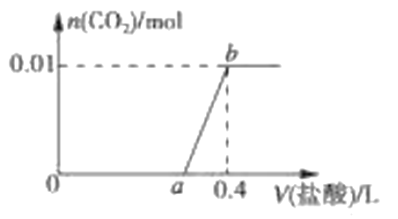
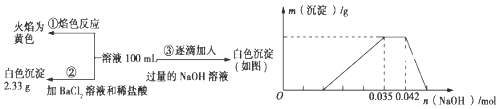
-
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是( )。
A. 在很多反应中IBr是强氧化剂
B. IBr与水反应时既作氧化剂,又作还原剂
C. IBr与AgNO3溶液反应会生成AgBr沉淀
D. IBr与NaOH溶液反应时,生成NaBr和NaIO
难度: 简单查看答案及解析
-
下列物质不属于合金的是( )
A. 黄铜 B. 青铜 C. 不锈钢 D. 水银
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 1 mol N2的质量为28 g/mol
B. 标准状况下,1 mol任何物质的体积均为22.4L
C. Cl2的摩尔质量为71 g
D. 常温常压下,32 g SO2 的物质的量为0.5mol
难度: 简单查看答案及解析
-
熔化氢氧化钠时,应选用的坩埚是( )
A. 铁坩埚 B. 石英坩埚 C. 刚玉坩埚 D. 陶瓷坩埚
难度: 简单查看答案及解析
-
下列有关物质颜色,正确的组合是( )
①FeSO4•7H2O 棕黄色 ②Fe2O3 红棕色 ③Fe(OH)2 白色
④Fe3O4 黑色 ⑤CuSO4•5H2O 白色 ⑥HCl 无色
A. ①②③④ B. ②③④⑥ C. ②③④⑤ D. ①②④⑥
难度: 简单查看答案及解析
-
分类法在化学学科的发展中起到了非常重要的作用。下列物质分类不合理的是( )
A. 酸性氧化物:CO2、SO2、SiO2 B. 碱性氧化物:Na2O2、MgO、CaO
C. 电解质:BaSO4、KAl(SO4)2•12H2O、HCl D. 胶体:烟水晶、硅酸溶胶、云雾
难度: 简单查看答案及解析
-
下列各组离子能够大量共存的是( )
A. 加入Al粉后产生H2的溶液中:Na+、HCO3﹣、SO42﹣、Cl¯
B. 滴加石蕊试剂变红的溶液中:Na+、Fe2+、NO3﹣、Cl¯
C. 酸性溶液中:Fe3+、K+、SCN¯、SO42﹣
D. 澄清透明的溶液中:Cu2+、H+、NH4+、SO42﹣
难度: 简单查看答案及解析
-
下列关于硅及其化合物的说法中,正确的是( )
A. 硅可用于制造光导纤维
B. 水泥、玻璃、水晶饰物都是硅酸盐制品
C. 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3(胶体)制取硅酸
D. SiO2既能与HF反应又能与强碱反应,所以SiO2是两性氧化物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. NaHCO3 的电离方程式是 NaHCO3═Na++H++CO32﹣
B. 向硫酸中通入少量氨气,硫酸溶液的导电能力会明显增强
C. 胶体和其它分散系的本质区别是分散质粒子大小为1﹣100nm
D. SO3溶于水后所得到的H2SO4溶液能导电,故SO3是电解质
难度: 简单查看答案及解析
-
同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的( )
①分子数②密度③质量④质子数⑤原子数⑥电子数
A. ①④⑥ B. ①②⑤ C. ③④⑥ D. ①②③
难度: 简单查看答案及解析
-
已知反应:
①Cl2+2KBr=2KCl+Br2,
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,
下列说法正确的是( )
A. 上述3个反应都是置换反应
B. ③中1 mol氧化剂参加反应得到电子的物质的量为10 NA
C. 反应②中若得到13.44L Cl2,则电子转移个数为6.02×1023
D. 氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2
难度: 简单查看答案及解析
-
由Na、Mg、Al、Fe 四种金属组成的混合物,与足量的稀硫酸反应,生成H2在标准状况下的体积为6.72L,则混合物的物质的量不可能为( )
A. 0.6mol B. 0.5mol C. 0.4mol D. 0.3mol
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A. 向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓
B. 向澄清石灰水中滴入少量NaHCO3溶液:Ca2++2OH﹣+2HCO3﹣═CaCO3↓+CO32﹣+2H2O
C. 已知:2Br﹣+Cl2=2Cl﹣+Br2,Br2+2Fe2+=2Fe3++2Br﹣,向含0.2molFeBr2的溶液中通入标准状况下3.36LCl2时,发生的反应为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣
D. 向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H++SO42﹣+Ba2++OH﹣═H2O+BaSO4↓
难度: 中等查看答案及解析
-
下列各操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向石灰水中通入过量的CO2
②向Ca(ClO)2溶液中通入过量CO2
③向氢氧化铝胶体中逐滴滴入过量稀氢氧化钠溶液
④向氯化钡溶液中逐渐通入过量二氧化碳
⑤向A1C13溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳
A. ②③⑤⑥ B. ①④⑤ C. ②④⑤⑥ D. ④⑤⑥
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是
A. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
B. 标准状况下,2.24LCCl4中含氯原子数为0.4NA
C. 1.8gNH4+中含有的电子数为1.1NA
D. 常温下,23gNO2和N2O4的混合气体含有NA个氧原子
难度: 简单查看答案及解析
-
Na投入水中发生剧烈反应,并有H2生成.装运金属钠的包装箱应贴的图标是( )
A.
 腐蚀品 B.
腐蚀品 B.  爆炸品
爆炸品C.
 遇湿易燃品 D.
遇湿易燃品 D.  氧化剂
氧化剂难度: 简单查看答案及解析
-
下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
难度: 简单查看答案及解析
-
下列装置及药品和实验室制备的气体相匹配的是( )
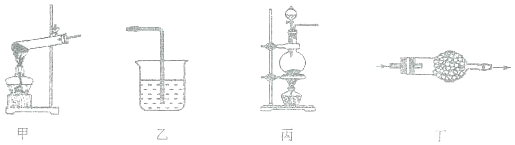
A. 甲装置用来制备氧气 B. 乙装置用来尾气处理氯化氢气体
C. 丙装置用来制取氯气 D. 丁装置中盛有碱石灰用来干燥二氧化碳气体
难度: 简单查看答案及解析
-
一定条件下,一种反应物过量,另一种反应物可以完全反应的是( )
A. 过量的水与氯气 B. 过量的氢氧化钠与二氧化硅
C. 过量的铜与浓硫酸 D. 过量的氨水与氢氧化铝
难度: 简单查看答案及解析
-
用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是( )
A. 漂白粉被氧化了 B. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C. 有色布条被空气中的氧气氧化 D. 漂白粉溶液失去了部分水分,浓度增大了
难度: 简单查看答案及解析
-
下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
难度: 中等查看答案及解析
-
某铁的“氧化物”样品,用5mol/L盐酸0.14L恰好完全反应,所得溶液还能吸收标准状况下2.24L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( )
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
难度: 困难查看答案及解析
-
将0.2molMn02和50mL12mol/L盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)( )
A. 等于0.3mol B. 小于0.3mol C. 大于 0.3mol,小于 0.6mol D. 等于 0.6mol
难度: 简单查看答案及解析