-
下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
B. 已知2C(s)+2O2(g)===2CO2(g) ΔH1, 2C(s)+O2(g)===2CO(g) ΔH2;则ΔH1<ΔH2
C. 已知2H2(g)+O2(g)===2H2O(g) ΔH =-483.6 kJ/mol,则H2的燃烧热为241.8 kJ/mol
D. 已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
难度: 简单查看答案及解析
-
下列说法不正确的是
A. Na2CO3溶液蒸干并灼烧可得无水Na2CO3
B. 除去MgCl2溶液中混有的少量FeCl3,可向溶液中加入足量MgCO3,过滤
C. pH相同的①CH3COONa、②NaClO的两种溶液的c(Na+):① < ②
D. 任何温度下均能自发进行2H2O2(l) = 2H2O(l) +O2(g),则该反应的△H<0,△S>0
难度: 中等查看答案及解析
-
下列有关实验操作的叙述错误的是
A. 测中和热实验时,用铜丝替代环形玻璃搅拌棒,测得ΔH数值偏低
B. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
C. 测定醋酸钠溶液的pH可用洁净的玻璃棒蘸取待测液,点在湿润的pH试纸上
D. 用已知浓度的盐酸测定未知浓度的氢氧化钠溶液,当滴定达终点时滴定管尖嘴有悬液,则测定结果偏高
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离的c(H+)=10-13 mol/L 的溶液中:Na+、NH4+、CH3COO-、HCO3-
B. c(H+)=10-12 mol/L的溶液中:K+、AlO2﹣、NO3-、SO42-
C. 能使甲基橙变红色的溶液中:Na+、K+、Cl-、SiO32-
D. 常温下的溶液中:Cl﹣、Al3+、Na+、AlO2﹣
难度: 中等查看答案及解析
-
已知分子式为C12H12的物质A的结构简式为
,其苯环上的一溴代物有几种同分异构体
A. 3种 B. 4种 C. 6种 D. 8种
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.
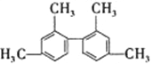 分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上难度: 中等查看答案及解析
-
某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
难度: 中等查看答案及解析
-
创建文明校园,学校全园禁烟,同学们也参与了“寻找烟头”活动。吸烟有害健康,烟草中的剧毒物尼古丁的结构简式为
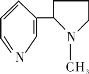 ,有关其叙述正确的是
,有关其叙述正确的是A. 该有机物属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 尼古丁分子中的六元环不是正六边形
D. 尼古丁的一氯代物有10种同分异构体
难度: 中等查看答案及解析
-
下列说法正确的是
A. 146 C 和 146 C 是不同种核素,化学性质也不相同
B. H2O 和H2O2 互为同素异形体
C. CH3COOCH2CH3 和 CH3CH2COOCH3 互为同系物
D. CH3CH(CH3)2 的名称叫 2-甲基丙烷,也可以叫做异丁烷
难度: 简单查看答案及解析
-
关于
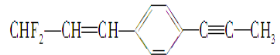 的分子结构说法正确的是
的分子结构说法正确的是A. 分子中12个碳原子一定在同一平面
B. 分子中有7个碳原子可能在同一直线上
C. 分子中最多有6个碳原子能在同一直线上
D. 分子中最多有8个碳原子能在同一直线上
难度: 困难查看答案及解析
-
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质的有机溶液迁移入 MnO2 晶格中,生成 LiMnO2。下列说法正确的是
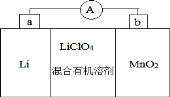
A. 外电路的电流方向是由 a 极流向 b 极。
B. 电池b 极反应式为 MnO2+e-+Li+=LiMnO2
C. 可用水代替电池中的混合有机溶剂
D. a 极发生还原反应
难度: 中等查看答案及解析
-
下列物质因发生水解而显碱性的是
A. HCl B. CH3COONa C. NH4Cl D. KOH
难度: 简单查看答案及解析
-
已知反应2CH3OH(g)
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/mol·L-1
0.44
0.6
0.6
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
难度: 中等查看答案及解析
-
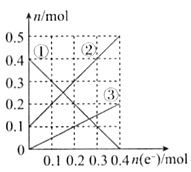
根据下列有关图象,说法正确的是
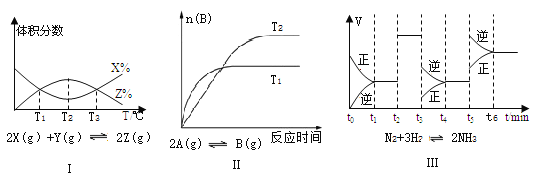
A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
难度: 中等查看答案及解析
-
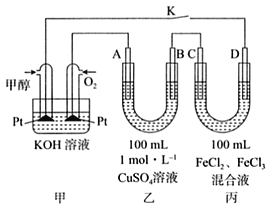
如图所示的装置,C、D、E、F、X、Y都是惰性电极,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
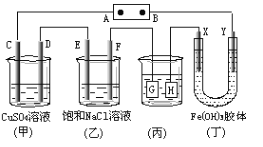
A. 电源B极是正极
B. 装置(丁)中X极附近红褐色变深,说明氢氧化铁胶粒带正电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
难度: 中等查看答案及解析
-
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)⇌2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
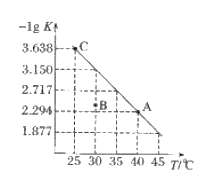
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=10−3.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的
难度: 困难查看答案及解析