-
下列说法正确的是( )
A. 基态原子的能量一定比激发态原子的能量低
B. 1s22s12p1表示的是基态原子的电子排布
C. 日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
难度: 简单查看答案及解析
-
某烷烃一个分子里含9个碳原子,其一氯取代物只有两种,这种烷烃的名称是( )
A. 正壬烷 B. 2,6—二甲基己烷
C. 2,2,4,4—四甲基戊烷 D. 2,3,4—三甲基己烷
难度: 中等查看答案及解析
-
分分子式为C5H7Cl的有机物,其结构不可能是( )
A. 只含有1个双键的直链有机物 B. 含2个双键的直链有机物
C. 含1个双键的环状有机物 D. 含一个三键的直链有机物
难度: 中等查看答案及解析
-
H2O分子中每个O原子结合2个H原子的根本原因是( )
A. 共价键的方向性 B. 共价键的饱和性
C. 共价键的键角 D. 共价键的键长
难度: 中等查看答案及解析
-
关于CS2、SO2、NH3三种物质的说法中正确的是 ( )
A. CS2在水中的溶解度很小,是由于其属于极性分子
B. SO2和NH3均易溶于水,原因之一是它们都是极性分子
C. CS2为非极性分子,所以在四种物质中熔沸点最低
D. NH3在水中溶解度很大只是由于NH3分子有极性
难度: 中等查看答案及解析
-
氮化硼(BN)是一种新型结构材料,具有超硬、耐磨、耐高温等优良特性,下列各组物质熔化时,所克服的微粒间作用与氮化硼熔化时克服的微粒间作用都相同的是( )
A. 硝酸钠和金刚石 B. 晶体硅和水晶
C. 冰和干冰 D. 苯和萘
难度: 简单查看答案及解析
-
下列关于化学键的叙述中正确的是( )
A. 化学键存在于原子之间,也存在于分子之间
B. 两个原子之间的相互作用叫做化学键
C. 离子键是阴、阳离子之间的相互吸引力
D. 化学键通常是指相邻的两个或多个原子之间强烈的相互作用
难度: 中等查看答案及解析
-
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流的作用下,氖原子与构成灯管的物质发生反应
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C. Y、Z形成的分子的空间构型可能是正四面体
D. WY2分子中σ键与π键的数目之比是2:1,属于分子晶体。
难度: 中等查看答案及解析
-
关于晶体和非晶体的说法,正确的是( )
A. 晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质
B. 晶体在熔化过程中需要不断的吸热,温度不断地升高
C. 普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同
D. 晶体和非晶体之间不可以相互转化
难度: 中等查看答案及解析
-
关于金属晶体的六方最密堆积的结构形式的叙述正确的是( )
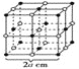
A. 晶胞是六棱柱 B. 晶胞是六面体
C. 每个晶胞中含4个原子 D. 每个晶胞中含17个原子
难度: 简单查看答案及解析
-
下列不同时期原子结构模型的提出时间排列正确的是( )
①电子分层排布模型 ②“葡萄干布丁”模型 ③量子力学模型 ④道尔顿原子学说 ⑤核式模型
A. ①③②⑤④ B. ④②③①⑤
C. ④②⑤①③ D. ④⑤②①③
难度: 简单查看答案及解析
-
下列轨道表示式能表示基态氮原子的核外电子排布的是( )
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4。下列相关叙述正确的是( )
A. 甲、乙、丙属同系物,均可与氯气、溴蒸气发生取代反应
B. C5H12表示一种纯净物
C. 甲、乙、丙中,丙的沸点最低
D. 丙有3种不同沸点的二氯取代物
难度: 中等查看答案及解析
-
在烧焦的鱼、肉中含有致癌物质3,4一苯并芘,其结构简式如图所示,它是一种稠环芳香烃,其分子式是( )

A. C20H12 B. C20H14 C. C19H12 D. C22H20
难度: 困难查看答案及解析
-
下列物质存在顺反异构的是( )
A. 乙烷 B. 乙烯 C. 2-丁烯 D. 乙炔
难度: 中等查看答案及解析
-
下列烷烃中,跟氯气反应生成的一氯代物只有两种,则该烷烃是( )
A. CH3CH2CH2CH2CH2CH3 B. (CH3)2CHCH2CH2CH3
C. CH3CH2CH (CH3)CH2CH3 D. (CH3)2CHCH(CH3)2
难度: 中等查看答案及解析
-
有人认为CH2==CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2==CH2一端碳原子结合,第二步才是Br-与另一端碳原子结合。如果让CH2==CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A. BrCH2CH2Br B. ClCH2CH2I
C. BrCH2CH2I D. BrCH2CH2Cl
难度: 中等查看答案及解析
-
某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A. HC≡CH B. CH2=CH2 C. CH3C≡CH D. CH2=C(CH3)2
难度: 中等查看答案及解析
-
奥运会火炬常使用的燃料是一种常用燃料,其分子式为
,它属于( )
A. 烷烃 B. 烯烃 C. 炔烃 D. 芳香烃
难度: 简单查看答案及解析
-
随着碳原子数的增多,碳元素的质量百分含量却增大的是( )
A. 烷烃同系物 B. 烯烃同系物 C. 炔烃同系物 D. 苯的同系物
难度: 中等查看答案及解析

 ②
② ⑤
⑤

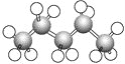 ⑨
⑨
 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________, 的系统命名是________________________________________________________________________,
的系统命名是________________________________________________________________________,