-
下列关于物质的表述不正确的是( )
A. 港珠澳大桥采用超高分子量聚乙烯纤维吊绳,其商品名为“力纶”是有机高分子化合物
B. 3D打印钛合金材料用于航天航空尖端领域是利用了钛合金密度小强度大等特点
C. 位于贵州省平塘县的中国天眼FAST使用的SiC是一种无机非金属材料
D. 泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
难度: 中等查看答案及解析
-
设NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 标况下,11.2L氟化氢中含有的电子数5NA
B. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
C. 100mL 0.1mol/L 的KAl(SO4)2溶液中含有的阳离子总数为0.02NA
D. 分别由H2O2和KMnO4制备等量的氧气转移的电子数目相等
难度: 困难查看答案及解析
-
下列关于有机物的说法正确的是( )
A. 甲烷和苯都是重要的化工原料,可从石油分馏中获得
B. 淀粉、菜籽油和蛋白质都是天然高分子化合物
C. 室温下,在水中的溶解度:乙醇大于溴乙烷
D.
苯乙烯在一定条件下可加聚反应,不可以发生取代反应
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
实验操作
实验现象
实验结论
A.
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
该溶液中有Fe2+,无Fe3+
B.
将溴乙烷与NaOH醇溶液加热反应产生的气体通入盛有酸性高锰酸钾的试管中
试管中的溶液紫色褪去
溴乙烷发生了消去反应,生成了乙烯气体
C.
向蔗糖与稀硫酸加热反应后的溶液中先加入过量的NaOH溶液,再加入少量新制的氢氧化铜悬浊液,加热5分钟
溶液中产生砖红色沉淀
蔗糖水解产生了葡萄糖
D.
用坩埚钳夹住一块铝箔在酒精灯上加热
铝箔熔化,失去光泽并滴落下来
金属铝的熔点较低
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
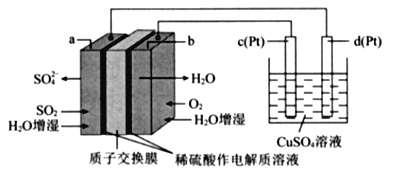
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次递增。X和Z形成的化合物的水溶液在常温下Ph=7,W和X的最外层电子数之和等于Z的最外层电子数,Y的原子序数是W的2倍,下列说法正确的是( )
A. Y的气态氢化物的稳定性强于Z的
B. W与X形成的化合物可能含有共价键
C. 原子半径大小:W<X<Y<Z
D. Y的单质易溶于水和乙醇
难度: 困难查看答案及解析
-
室温下向10mL0.1mol/LKOH溶液中加入0.1mol/L的一元酸HX,溶液pH的变化曲线如图所示。下列说法正确的是( )
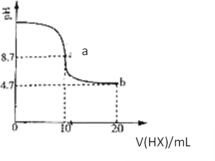
A. a、b两点对应的溶液中水电离出的氢离子浓度:a>b
B. a点对应的溶液中存在:c(K+)>c(X-)>c(H+)>c(HX)
C. 当溶液pH=7时,c(K+)=c(X-)+c(HX)
D. b点对应的溶液中c(X-)< c(HX)
难度: 困难查看答案及解析
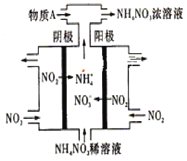
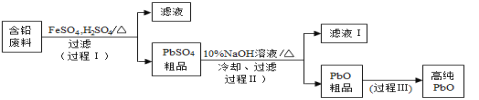
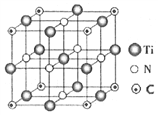
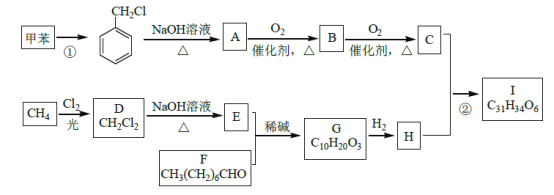
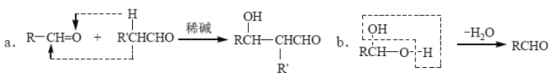
 )____________。
)____________。