-
下列各组物质中,酸性由强到弱排列顺序错误的是( )
A. HClO4 H2SO4 H3PO4 B. HClO4 HClO3 HClO2
C. HClO HBrO4 HIO4 D. H2SO4 H2SO3 H2CO3
难度: 中等查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A. C3N4晶体是分子晶体
B. C3N4晶体中C—N键的键长比金刚石中C—C键的键长要长
C. C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D. C3N4晶体中微粒间通过离子键结合
难度: 中等查看答案及解析
-
1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似,物理性质相近。据上述原理,下列各对粒子中,空间结构相似的是( )
A. SO2和O3 B. CO2和NO2
C. CS2和NO2 D. PCl3和BF3
难度: 中等查看答案及解析
-
下列有关晶体和非晶体的说法中正确的是( )
A. 具有规则几何外形的固体均为晶体
B. 晶体具有自范性,非晶体没有自范性
C. 晶体研碎后即变为非晶体
D. 将玻璃加工成规则的固体即变成晶体
难度: 简单查看答案及解析
-
假设原子晶体SiO2中,Si原子被铝原子取代,不足的价数由钾原子补充.当有25%的硅原子被铝原子取代时,可形成正长石.则正长石的化学组成为( )
A. KAlSiO4 B. KAlSi2O6 C. KAlSi2O8 D. KAlSi3O8
难度: 困难查看答案及解析
-
元素X、Y、Z的原子序数之和为28,X+与Z2-具有相同的电子层结构,Y、Z在同一周期。下列推测错误的是( )
A. 原子半径:X>Y,离子半径:Z2->X+
B. X单质与Z单质反应的物质的量之比一定为2∶1
C. Y与Z形成的化合物ZY2中,Z为+2价
D. 所有元素中Y的气态氢化物稳定性最强
难度: 中等查看答案及解析
-
具有如下电子层结构的原子,其相应元素一定属于同一主族的是( )
A. 3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子
B. 3p能级上只有1个空轨道的原子和4p能级上只有1个空轨道的原子
C. 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子
D. 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
难度: 简单查看答案及解析
-
按电子排布可把周期表里的元素划分成5个区,以下元素属于s区的是( )
A. Fe B. Mg C. Al D. La
难度: 简单查看答案及解析
-
化学上通常把原子数和电子数相等的分子或离子称为等电子体,研究发现等电子体间结构和性质相似(等电子原理).化合物B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是( )
A. 无机苯是仅由极性键组成的分子
B. 无机苯能发生取代反应
C. 无机苯的二氯代物有3种同分异构体
D. 无机苯不能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )

A. MgB B. MgB2 C. Mg2B D. Mg3B2
难度: 中等查看答案及解析
-
下列分子中存在的共价键类型完全相同的是( )
A. CH4与NH3 B. C2H6与C2H4 C. H2与Cl2 D. Cl2与N2
难度: 中等查看答案及解析
-
判断物质在不同溶剂中的溶解性时,一般都遵循“相似相溶”规律。下列装置中,不宜用做HCl尾气吸收的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
下列各组物质的沸点,按由低到高顺序排列的是( )
A. NH3、CH4、NaCl、Na B. H2O、H2S、MgSO4、SO2
C. CH4、H2O、NaCl、SiO2 D. Li、Na、K、Rb、Cs
难度: 中等查看答案及解析
-
宇宙中最多的元素是( )
A. H B. O C. He D. N
难度: 简单查看答案及解析
-
下图为铜锌原电池示意图,下列说法正确的是( )
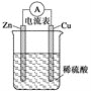
A. 锌片逐渐溶解
B. 烧杯中溶液逐渐呈蓝色
C. 电子由铜片通过导线流向锌片
D. 锌为正极,铜为负极
难度: 简单查看答案及解析
-
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O
HCO3-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡向逆反应方向移动,水解程度减小
B. 通入CO2,平衡向正反应方向移动
C. 升高温度,c(HCO3-)/c(CO32-)减小
D. 加入NaOH固体,溶液pH减小
难度: 中等查看答案及解析
-
有一化学平衡mA(g)+nB(g)
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )

A. 正反应是放热反应;m+n>p+q
B. 正反应是吸热反应;m+n<p+q
C. 正反应是放热反应;m+n<p+q
D. 正反应是吸热反应;m+n>p+q
难度: 困难查看答案及解析
-
目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS
Na2Sx。以下说法正确的是( )
A. 放电时,钠作正极,硫作负极
B. 放电时,Na+向负极移动
C. 充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D. 放电时,负极发生的反应是:2Na-2e-===2Na+
难度: 中等查看答案及解析
-
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
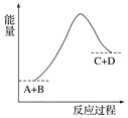
A. 该反应为放热反应
B. 该反应为吸热反应
C. 反应物的总能量高于生成物的总能量
D. 该反应只有在加热条件下才能进行
难度: 简单查看答案及解析
-
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。下列说法不正确的是( )
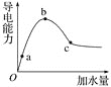
A. 在O点时,醋酸不导电
B. a、b、c三点,a点时醋酸溶液中H+浓度最小
C. b点时,醋酸电离程度最大
D. 可通过微热的方法使c点溶液中c(CH3COO-)增大
难度: 中等查看答案及解析
-
常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液中c(H+)最接近于( )
A. (10-8+10-10)mol·L-1 B. (10-4+10-6)mol·L-1
C. (10-8+10-10)/2mol·L-1 D. 2×10-10mol·L-1
难度: 中等查看答案及解析
-
用石墨作电极电解CuCl2和KCl的混合溶液,电解初期阴极和阳极分别析出的物质是( )
A. H2、Cl2 B. Cu、Cl2 C. H2、O2 D. Cu、O2
难度: 中等查看答案及解析
-
把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,
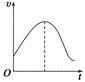
在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①②③ D. ②③
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
难度: 中等查看答案及解析




 。
。
