-
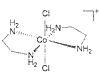
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
难度: 中等查看答案及解析
-
决定元素种类的因素是
A. 核外电子数 B. 最外层电子数 C. 核电荷数 D. 中子数
难度: 简单查看答案及解析
-
2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如
、
等。下列说法正确的是
A.
和
的化学性质完全不同
B. 元素Ts的相对原子质量为
C. 基态
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是
根据如表所列数据判断,错误的是
元素
X
496
4562
6912
9543
Y
578
1817
2745
11575
A. 元素X的常见化合价是
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应
难度: 中等查看答案及解析
-
若某原子在处于能量最低状态时,外围电子排布为
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
难度: 中等查看答案及解析
-
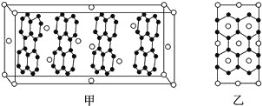
四种短周期元素在周期表中的位置如图,其中M为非金属元素
下列说法正确的是
A. M的最高价氧化物为一种酸酐
B. Z的离子半径是同周期各简单离子中最小的
C. X的气态氢化物的稳定性比Y的强
D. Z的氢化物酸性是同族中最强的
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表:
元素代号
X
Y
Z
W
原子半径
160
143
70
66
主要化合价
、
、
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
难度: 中等查看答案及解析
-
下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
难度: 中等查看答案及解析
-
下列说法中,不正确的是
A. 光谱分析可用于元素检测,稀有气体He就是在分析太阳光谱时发现的
B. X射线衍射实验是区别晶体与非晶体的最科学的方法
C. 等电子体具有相同的价电子总数,导致它们具有相同的化学性质
D. 分子中只含极性键的分子不一定是极性分子。
难度: 中等查看答案及解析
-
含硫单质的水可治皮肤病,而硫难溶于水,微溶于酒精,易溶于
,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
A.
B. 氯仿 C.
D. 酒精
难度: 中等查看答案及解析