-
短周期元素X、Y、M、R在周期表中的相对位置如图,最外层电子数之和为24。下列说法正确的是
X
Y
M
R
A. Y的氢化物中一定不存在非极性键
B. X的氢化物与R的氢化物反应,产物的水溶液呈碱性
C. 食品中可适量添加MY2,起到去色、杀菌、抗氧化的作用
D. 氧化物对应的水化物的酸性:R>M
难度: 中等查看答案及解析
-
很多诗句或谚语都包含了丰富的化学知识,下列说法不正确的是
A. “雷雨发庄稼”说明有铵盐生成
B. “落汤螃蟹着红袍”涉及化学变化
C. “水乳交融”“火上浇油”前者涉及物理变化,后者涉及化学变化
D. “忽闻海上有仙山,山在虚无缥渺间”的海市蜃楼是一种自然现象,与胶体知识有关
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下,2.24LHF与1.8gH2O分子所含电子数目均为NA
B. 14g用于考古测年的14C原子中含中子数为8NA
C. 钠与氧气反应生成1molNa2O2时,转移电子数目为2NA
D. 28g乙烯中含有的共价键数目为6NA
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③ B. ①②⑤ C. ①②⑤⑥ D. ①②④⑤⑥
难度: 中等查看答案及解析
-
下列选项中的操作、现象与结论完全一致的是( )
选项
操作
现象
结论
A
将苯滴入溴水中,振荡、静置
溴水层褪色
溴和苯发生加成反应
B
无水乙醇与浓硫酸共热至170℃,将产生气体通入溴水
溴水褪色
乙烯和溴水发生加成
C
向CuSO4溶液中通入H2S
出现黑色沉淀
酸性:H2S>H2SO4
D
向AgCl 悬浊液中滴加饱和Na2S 溶液
有黑色沉淀产生
Ksp(Ag2S)< Ks(AgCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
H2S燃料电池应用前景非常广阔,该电池示意图如下。下列说法正确的是
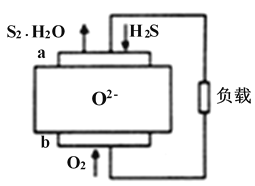
A. 电极a是正极
B. O2-由电极a移向电极b
C. 电极 a 的反应式为:2H2S+2O2--4e-=S2+2H2O
D. 当通入1.12LO2,转移电子数0.2NA
难度: 困难查看答案及解析
-
已知常温时 HClO 的 Ka=3.0×10-8,HF 的 Ka= 3.5×10-4。现将 pH 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH 随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线 I 为次氯酸稀释时 pH 变化曲线
B. 取 a 点的两种酸溶液,中和相同体积、相同浓度的NaOH 溶液,消耗次氯酸的体积较小
C. a 点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b 点溶液中水的电离程度比 c 点溶液中水的电离程度小
难度: 困难查看答案及解析



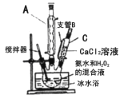
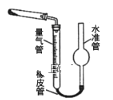

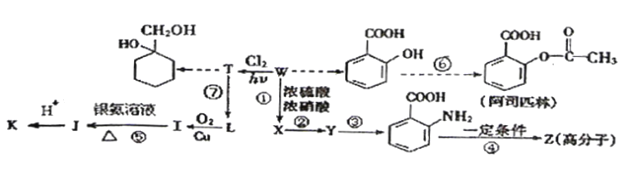
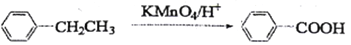 ;
; (苯胺,易被氧化)
(苯胺,易被氧化)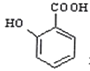 有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。
有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。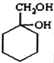 的过程(无机试剂任选) :(仿照
的过程(无机试剂任选) :(仿照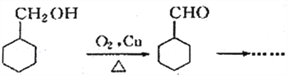 )_____________________
)_____________________