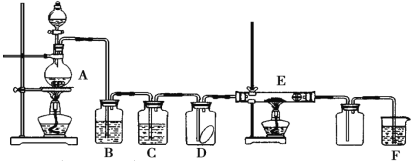
-
验证Fe3+与Fe2+能够相互转化。
按下列顺序实验
对应现象
①向FeCl3溶液加入少量铁粉
②滴加KSCN溶液
③再滴加几滴氯水
ⅰ.溶液由黄色变为浅绿色
ⅱ.溶液无明显变化
ⅲ.溶液变红
下列分析不合理的是
A. 解释现象ⅰ的反应 2Fe3+ + Fe =3Fe2+ B. 实验②与③可以调换顺序
C. 溶液变红涉及到反应Cl2 + 2Fe2+=2Cl- + 2Fe3+ D. 比较氧化性:Cl2>Fe3+>Fe2+
难度: 中等查看答案及解析
-
向BaCl2溶液依次通入气体X和Y,下列各组不会出现沉淀的是( )
选项
X
Y
A
NH3
CO2
B
Cl2
CO2
C
SO2
NO2
D
Cl2
SO2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列属于自然固氮的是
A.N2和O2在雷电作用下生成NO B.某金属化合物将氮气转化为化合态氮
C.在一定条件下使N2、H2合成NH3 D.NO生成NO2
难度: 简单查看答案及解析
-
下列物质只能作还原剂的是
A. S2- B. Fe2+ C. SO32- D. K+
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A. 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染
B. 指南针是我国的四大发明之一,制造指南针的磁性物质是Fe3O4
C. 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不相同
D. CaO 溶于水形成的溶液能导电,所以 CaO 是电解质
难度: 简单查看答案及解析
-
化学就是在原子、分子水平上研究物质的
①组成 ②结构 ③性质 ④变化 ⑤制备 ⑥应用
A. ①②③④ B. ②③④⑤ C. ③④⑤⑥ D. 全部
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A. 钠在氯气中燃烧产生白色烟雾
B. 铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜
C. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
D. 向KI 溶液中滴入少量的氯水和适量CCl4,振荡、静置,可观察到溶液分层,下层呈紫红色
难度: 简单查看答案及解析
-
下列物质中,不属于电解质的是
A. SO3 B. NaCl C. H2SO4 D. KOH
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. H2SO4===H2++SO42-
B. Ca(OH)2===Ca2++(OH)2-
C. AlCl3===Al+3+3Cl-1
D. Al2(SO4)3===2Al3++3SO42-
难度: 简单查看答案及解析
-
下列物质不能通过化合反应生成的是
A. NaHCO3 B. Mg(OH)2 C. CuCl2 D. Fe(OH)3
难度: 中等查看答案及解析
-
下列实验装置或操作与粒子直径的大小无直接关系的是
A. 过滤
 B. 渗析
B. 渗析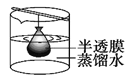
C. 萃取
 D. 丁达尔效应
D. 丁达尔效应
难度: 简单查看答案及解析
-
下列溶液中,跟 100 mL 0.5 mol•L-1 NaCl 溶液中所含的 Cl-物质的量浓度相同的是
A. 100 mL 0.5 mol•L-1 MgCl2溶液 B. 200 mL 0.25 mol•L-1 AlCl3溶液
C. 50 mL 1 mol•L-1 NaCl 溶液 D. 25 mL 0.5 mol•L-1 HCl 溶液
难度: 简单查看答案及解析
-
设 NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.3NA
B. 0.1 mol•L-1 的 FeCl3 溶液中 Cl-的数目为 0.3NA
C. 标准状况下,11.2L 水中含有原子的数目为 1.5NA
D. 1 mol Cl2 与足量的铁反应转移的电子数目是 2 NA
难度: 中等查看答案及解析
-
下图所表示的一些物质或概念间的从属关系不正确的是
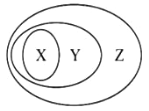
X
Y
Z
A
置换反应
氧化还原反应
离子反应
B
冰水混合物
电解质
化合物
C
淀粉溶液
胶体
分散系
D
干冰
氧化物
纯净物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
能实现下列物质间直接转化的元素是
单质
氧化物
酸或碱
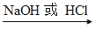 盐
盐A. 氮 B. 硫 C. 氯 D. 铜
难度: 简单查看答案及解析
-
关于 Na2CO3 和 NaHCO3 性质的说法不正确的是
A. 热稳定性:NaHCO3<Na2CO3
B. 与同浓度盐酸反应的剧烈程度:NaHCO3<Na 2CO3
C. 相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D. 等物质的量的 Na2CO3、NaHCO3 分别与足量盐酸反应产生的 CO2 质量相同
难度: 简单查看答案及解析
-
下列溶液中:①石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是( )
A. ①⑦ B. ①⑤⑦ C. ②③④⑤⑥ D. ①⑤
难度: 中等查看答案及解析
-
合理使用仪器、恰当存放药品是化学实验安全、顺利进行的保障。下列“使用方法”与对应的“应用举例”不相符的是
使用方法
应用举例
A
验纯后加热
CO 还原 Fe2O3
B
振荡分液漏斗后放气
CCl4 萃取溴水中的 Br2
C
先撤导管后撤酒精灯
Cu、浓 H2SO4 制 SO2
D
剩余药品不能放回原瓶
Na 块
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,下列各溶液中,离子一定能大量共存的是
A. 在强碱性溶液中:Na+、K+、HCO3-、Cl-
B. pH=1 的溶液中:ClO-、NH4+、NO3-、Ca2+
C. 透明溶液中:Cu2+、NO3-、Cl-、H+
D. 无色溶液中:H+、K+、Fe3+、SO42-
难度: 中等查看答案及解析
-
以下离子检验的方法和结论正确的是
A. 先加入BaCl2 溶液,再加入足量HNO3溶液,产生白色沉淀,溶液中一定含有SO42-
B. 加入足量的CaCl2溶液,产生白色沉淀,溶液中一定含有CO32-
C. 加入足量浓NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,溶液中一定含有 NH4+
D. 先加入适量盐酸将溶液酸化,再加入AgNO3溶液,产生白色沉淀,溶液中一定含有Cl-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 海水提溴的原理:2Br-+Cl2==2Cl-+Br2
B. 氢氧化钠溶液与醋酸反应:OH- + H+ == H2O
C. 大理石与稀盐酸反应:CO3 2- + 2H+== CO2↑ + H2O
D. 钠加入水中:Na+H2O == Na++OH-+H2↑
难度: 中等查看答案及解析
-
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
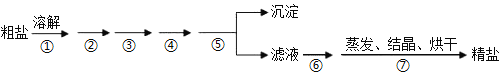
A. 在第①步中使用玻璃棒搅拌可加速粗盐溶解
B. 第⑤步操作是过滤
C. 在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸
D. 除去MgCl2的离子方程式为:Mg2++2OH−=Mg(OH)2↓
难度: 中等查看答案及解析
-
国产航母 001A 等舰艇的船底都涂有含 Cu2O 的防污涂料,制备 Cu2O 的一种方法为:Zn+2CuSO4+2NaOH===Cu2O+ZnSO4+Na2SO4+H2O。该反应的下列说法正确的是
A. Zn 得到电子 B. CuSO4 被氧化 C. CuSO4 是氧化剂 D. NaOH 是还原剂
难度: 简单查看答案及解析
-
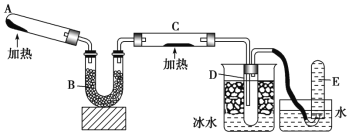
某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
难度: 中等查看答案及解析