-
下列关于硅及其化合物的说法中,正确的是( )
A. 硅可用于制造光导纤维
B. 水泥、玻璃、水晶饰物都是硅酸盐制品
C. 可用反应Na2SiO3+2HCl═2NaCl+H2SiO3(胶体)制取硅酸
D. 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
难度: 简单查看答案及解析
-
下列关于胶体的说法正确的是( )
A. Fe(OH)3胶体具有吸附性,可用于净水
B. 胶体与其他分散系的本质区别是胶体有丁达尔效应,而其他分散系没有
C. 胶体粒子的直径小于1 nm
D. 胶体的分散质可以通过过滤的方法与分散剂分离
难度: 简单查看答案及解析
-
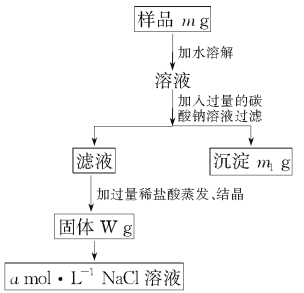
粗盐中含有不溶性泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等.精制食盐水的实验操作顺序如下:①加入过量BaCl2溶液,②加入过量NaOH溶液,③加入过量Na2CO3溶液,④过滤,⑤加入适量盐酸.下列说法不正确的是( )
A. ①②③中加入过量的试剂是为了完全除去相应的杂质离子
B. ⑤中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量”
C. 因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好
D. ③中加入过量Na2CO3溶液仅为了完全除去Ca2+
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同温同压下,相同数目的分子必具有相同的体积
B. 等质量的O2 和H2 的物质的量之比为l6:1
C. 不同的气体若体积不等,则它们所含的分子数一定不等
D. 同温同体积下,两种气体的物质的量之比等于压强之比
难度: 中等查看答案及解析
-
下列有关金属及其化合物的知识说法正确的是( )
A. 可用Na与MgCl2溶液反应制Mg
B. 金属单质导电与电解质溶液导电原因相同
C. 常温下氧气与铝不反应,故常温下铝制品可以广泛应用。
D. 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+
难度: 简单查看答案及解析
-
下列各组物质在溶液中反应时,以任意比混合均能用同一离子方程式表示的是( )
A. AlCl3溶液和NaOH溶液
B. Ba(OH)2溶液与稀硫酸
C. Na2CO3溶液和稀盐酸
D. CO2和澄清石灰水
难度: 简单查看答案及解析
-
在无色强酸性溶液中,下列各组离子能够大量共存的是 ( )
A. Cl -、Na+、NO3-、Ca2+ B. NH4+、HCO3-、Cl-、K+
C. K+、Ba2+、Cl-、SO42- D. Cu2+、NH4+、I-、Cl-
难度: 简单查看答案及解析
-
在生产、生活及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成。下列有关物质检验的说法正确的是( )
A. 炭粉、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
B. (NH4)2SO4、K2SO4、NH4Cl三种物质不能用一种试剂通过化学反应区别开
C. 可以用NaOH溶液检验FeCl3溶液中是否混有FeCl2
D. 用湿润的淀粉KI试纸可以检验氯化氢气体中是否含有氯气
难度: 中等查看答案及解析
-
等质量的钠进行下列实验,其中生成氢气最多是( )
A. 将钠投入到足量水中
B. 将钠用铝箔包好并刺一些小孔,再放人足量的水中
C. 将钠放入足量稀硫酸中
D. 将钠放入足量稀盐酸中
难度: 中等查看答案及解析
-
下列物质中既能导电,又属于电解质的一组物质是( )
A. 石墨、醋酸溶液、食盐晶体
B. 熔融状态的KOH、熔融状态的NaCl
C. 稀H2SO4、NaOH溶液、纯HNO3
D. 液氨、石灰水、水银
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、AL3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,反应完全后,离子数目几乎没有变化的是( )
A. Fe3+ B. Fe2+ C. AL3+ D. NH4+
难度: 简单查看答案及解析
-
证明某溶液中只含Fe2+而不含有Fe3+的实验方法是( )
A. 先加氯水,再滴加KSCN溶液后显红色
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显血红色
C. 滴加NaOH溶液,产生红褐色沉淀
D. 只需要滴加KSCN溶液
难度: 中等查看答案及解析
-
2.3g纯净的金属钠在干燥的空气中被氧化后得到3.5g固体,由此可判断其氧化产物是
A. 只有Na2O B. 只有Na2O2 C. Na2O和Na2O2 D. 无法确定
难度: 中等查看答案及解析
-
下列分离、提纯、鉴别物质的方法正确的是( )
A. 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
C. 用过滤的方法除去蔗糖溶液中含有的少量淀粉胶体
D. 用加热、过滤、蒸发的方法可以除去粗盐中的泥沙、CaCl2、MgCl2等杂质
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的物质是( )
①NaHCO3②Al2O3③Al(OH)3④Al⑤(NH4)2CO3
A. 全部 B. ①②③ C. ①②③⑤ D. ②③④
难度: 中等查看答案及解析
-
菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法正确的是( )
A. “两者同食”发生的反应中维生素C作氧化剂
B. 五价砷在维生素C作用下发生了还原反应
C. 因为河虾中含有砷元素,所以不能食用
D. 可以推测砒霜中所含的砷元素化合价为+5
难度: 困难查看答案及解析
-
某学生配置0.1mol.L-1的NaOH溶液480mL,下列说法正确的是( )
A. 选用480mL容量瓶
B. 把烧碱固体放在纸上称量
C. 把称好的固体放入容量瓶中稀释至刻度线
D. 定容时俯视容量瓶的刻度线浓度偏大
难度: 简单查看答案及解析
-
向某无色透明溶液中加入铝片,立刻有大量氢气产生,则下列离子在该溶液中一定不会大量存在的是(____)
A.Na+ B.NO3- C.CO32- D.HCO3-
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA
B. 标准状况下,22.4LH2O所含有原子数为3NA
C. NA个N2分子所占的体积与0.5 NA个H2分子所占的体积比一定是2:1
D. 1 molNa2O2与H2O完全反应,转移2NA个电子
难度: 中等查看答案及解析
-
在同温同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两种气体的物质的量之比( )
A. 2:1 B. 1:2 C. 2:3 D. 1:3
难度: 简单查看答案及解析
-
将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol·L-1的NaOH溶液150mL。则原稀硫酸中H2SO4的物质的量浓度为( )
A. 1.5mol·L-1 B. 0.5mol·L-1 C. 2mol·L-1 D. 1.2mol·L-1
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是 ( )
A. 向Na2SiO3溶液中通入过量CO2:SiO32-+ CO2+ H2O=H2SiO3↓+ CO32-
B. 铁和稀硝酸反应:Fe + 2H+=H2↑+ Fe2+
C. 向AlCl3溶液中加入过量的NaOH溶液:Al3+ + 3OH- = Al(OH)3↓
D. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O===4Na++2Cu(OH)2↓+O2↑
难度: 中等查看答案及解析
-
200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )
A. 0.2mol B. 0.6mol C. 0.8mol D. l.0mol
难度: 中等查看答案及解析
-
己知钡的活动性处于Na、K之间,则下列说法中可能实现的是( )
A. Ba可从KCl溶液中置换出钾 B. Ba可从冷水中置换出氢
C. 在溶液中Zn可还原Ba2+生成Ba D. Ba投入到NaOH溶液中,没有明显的现象
难度: 简单查看答案及解析
-
有关焰色反应的说法正确的是
A. 焰色反应是金属单质表现的性质
B. 焰色反应是因为发生了化学变化而产生的
C. 焰色反应看到黄色火焰并不能确定该物质一定不含钾元素
D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸
难度: 简单查看答案及解析
-
下列铁的化合物:①FeCl2;②Fe(OH)3;③FeCl3,其中能通过化合反应直接制得的是( )
A. 只有①② B. 只有②③ C. 只有①③ D. 全部
难度: 简单查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。据此,下列说法不正确的( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于ClO2的氧化性
D. 每生成1 mol ClO2,转移的电子数约为6.02×1023
难度: 中等查看答案及解析
-
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A. 0.1mol B. 0.5mol C. 0.15mol D. 0.25mol
难度: 中等查看答案及解析
-
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中( )
A. 有铁粉无铜粉 B. 有铜粉无铁粉 C. 铁、铜粉都有 D. 铁、铜粉都无
难度: 简单查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
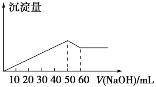
A. 6∶1 B. 3∶1 C. 2∶1 D. 1∶2
难度: 困难查看答案及解析