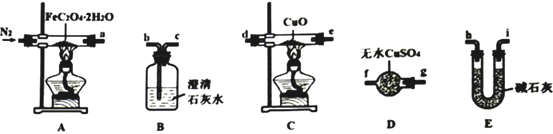
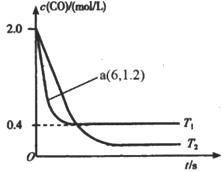
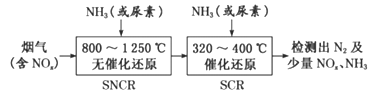
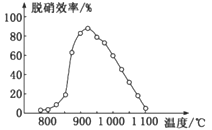
-
化学与生产、生活密切相关。下列说法不正确的是
A. 沥青常用于铺路,可以通过石油分馏得到
B. 静电除尘、血液透析利用了胶体聚沉的性质
C. 液态植物油与氢气加成后可以得到像动物脂肪一样的固态物质,称为人造脂肪
D. 大气中的二氧化硫和二氧化氮溶于雨水形成pH小于5.6的酸雨,具有很大危害
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1mol硝基(-NO2)与46g二氧化氮(NO2)所含的电子数均为23NA
B. 0.1mol/L(NH4)2SO4溶液与0.2 mol/LNH4Cl溶液中的NH4+数目相同
C. 标准状况下,2.24L三氯甲烷中含碳氯共价键的数目为0.3NA
D. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子数为NA
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
难度: 中等查看答案及解析
-
下列根据实验操作、现象及结论均正确的是
选项
实验操作
实验现象
实验结论
A
将石蜡油催化分解产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
该气体为乙烯
B
向NaAlO2溶液中持续通入气体Y
先出现 白色沉淀,最终沉淀又溶解
Y可能是CO2气体
C
向等量同浓度的H2O2溶液中分别加入CuCl2、FeCl3溶液
加FeCl3溶液的H2O2产生气泡较快
Fe3+对H2O2分解的催化效果较好
D
取CH3OONa溶液于试管中并加入几滴酚酞,再加热
溶液红色加深
CH3COONa溶液显碱性且存在水解平衡
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生 Fenton反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法正确的是
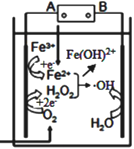
A. 电源的A极为正极
B. 与电源B相连电极的电极反应式为H2O+e-=H++·OH
C. Fenton反应为:H2O2+Fe2+=Fe(OH)2·OH
D. 每消耗22.4LO2(标准状况),整个电解池中理论上可产生的·OH为2mol
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。X的气态氢化物常用作制冷剂。ZYW2能与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法错误的是
A. 离子半径:Y<X<W<Z
B. 简单氢化物的稳定性:Y>W>Z
C. 把ZY2通入石蕊溶液中先变红后褪色
D. 向ZYW2与水反应后的溶液中滴加氯化钡溶液无明显现象
难度: 中等查看答案及解析
-
已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是

A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
难度: 困难查看答案及解析