-
下面的排序不正确的是( )
A. 晶体熔点由低到高:F2<Cl2<Br2<I2
B. 熔点由高到低: Na>Mg>Al
C. 硬度由大到小: 金刚石>碳化硅>晶体硅
D. 晶格能由大到小: MgO>CaO>NaF> NaCl
难度: 中等查看答案及解析
-
已知含氧酸可用通式XOm(OH)n表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是 ( )
A.HClO3 B.H2SeO3
C.H2BO2 D.HMnO4
难度: 简单查看答案及解析
-
如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
A. ⅢA或ⅢB
B. ⅣA
C. ⅠB
D. ⅠA
难度: 中等查看答案及解析
-
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( )
A. VSEPR模型可用来预测分子的立体构型
B. 分子中价电子对相互排斥决定了分子的立体构型
C. 中心原子上的孤对电子也要占据中心原子周围的空间并参与互相排斥
D. 分子中键角越大,价电子对相互排斥力越大,分子越稳定
难度: 简单查看答案及解析
-
下列微粒的核外电子排布式书写违反泡利原理的是 ( )
A. C:1s22s22p2
B. Na+:1s22s22p43s2
C. S2-:1s22s22p23s23p4
D. K:1s22s22p63s23p7
难度: 简单查看答案及解析
-
化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
难度: 简单查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B. S(s)+3/2O2(g)=SO3(s) △H2
C. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D. 2CO(g)+O2(g)=2CO2(g) △H4
难度: 中等查看答案及解析
-
元素周期表中前七周期元素种数如下:
周期序数
1
2
3
4
5
6
7
元素种类
2
8
8
18
18
32
32
请分析周期序数与元素种数的关系,然后预言第八周期最多可能含有的元素种数为( )
A. 18 B. 32 C. 50 D. 第64
难度: 中等查看答案及解析
-
下列有关晶体的说法中一定正确的是( )
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A. ①③⑦ B. 只有⑥ C. ②④⑤⑦ D. ⑤⑥⑧
难度: 中等查看答案及解析
-
依据价层电子对互斥理论判断SO2的分子构型
A. 正四面体形 B. 平面三角形 C. 三角锥形 D. V形
难度: 中等查看答案及解析
-
下列现象与氢键有关的是
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A. ②③④⑤ B. ①②③⑤
C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列物质中,属于含有极性共价键的离子晶体的是
A. CsCl B. KOH C. H2O D. Na2O2
难度: 简单查看答案及解析
-
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车备受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A. ①② B. ①③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列物质属于原子晶体的是( )
A. 熔点是1070℃,易溶于水,水溶液能导电
B. 熔点是10.31℃,液态不导电,水溶液能导电
C. 不溶于水,熔点3550℃,不导电
D. 熔点是97.80℃,质软、导电,密度是0.97g•cm-3.
难度: 中等查看答案及解析
-
二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )
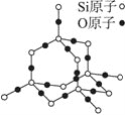
A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
难度: 中等查看答案及解析
-
根据π键的成键特征判断C=C的键能是C—C键能的( )
A. 2倍 B. 大于2倍 C. 小于2倍 D. 无法确定
难度: 中等查看答案及解析
-
已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数分别为( )

A. 14、6 B. 14、8 C. 4、8 D. 4、12
难度: 简单查看答案及解析
-
下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
难度: 中等查看答案及解析
-
当A,B两种元素原子分别获得两个电子形成8电子稳定结构时,A放出的能量大于B放出的能量;C,D两元素的原子分别失去1个电子形成8电子稳定结构时,D吸收的能量大于C吸收的能量,A、B、C、D之间分别形成化合物时,最容易形成离子化合物的是( )
A. D2A B. C2B C. C2A D. D2B
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同一原子中,2p、3p、4p能级的轨道数依次增多
B. 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C.
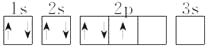 表示的原子能量处于最低状态
表示的原子能量处于最低状态D. 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
难度: 简单查看答案及解析
-
在白磷(P4)分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成键特点,下列有关白磷的说法正确的是 ( )
A. 白磷分子的键角为109°28′
B. 分子中共有4对共用电子对
C. 白磷分子的键角为60°
D. 分子中有6对孤电子对
难度: 中等查看答案及解析
-
下列分子的中心原子的杂化轨道类型相同的是 ( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H4与C2H2
难度: 中等查看答案及解析
-
只有阳离子而没有阴离子的晶体是
A. 金属晶体 B. 原子晶体 C. 分子晶体 D. 无法判断
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A. -488.3 kJ·mol-1 B. -191 kJ·mol-1
C. -476.8 kJ·mol-1 D. -1 549.6 kJ·mol-1
难度: 中等查看答案及解析

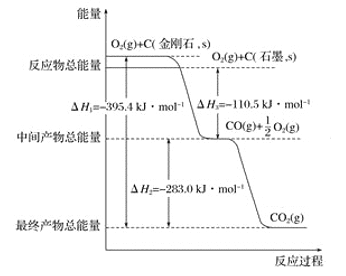


 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
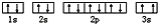 该同学所画的电子排布图违背了__;
该同学所画的电子排布图违背了__;