-
阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4 L的SO3中含有的SO3分子数为NA
B. 1 mol Cl2参加反应转移电子数一定为2NA。
C. 50 mL 18 mol/L浓硫酸与足量铜共热产生SO2的分子数为0.45NA。
D. 含1 mol FeCl3的溶液与沸水作用形成Fe(OH)3胶粒数目小于NA。
难度: 中等查看答案及解析
-
下列关于硫的叙述中不正确的是
A. 实验室常用酒精除去附着在试管壁上的硫黄
B. 单质硫既有氧化性,又有还原性
C. SO2通入酸性高锰酸钾溶液中使之褪色说明SO2具有还原性
D. SO2通入饱和H2S溶液中析出浅黄色沉淀说明SO2具有氧化性
难度: 简单查看答案及解析
-
某同学在实验室中用Ca(ClO)2代替MnO2制备Cl2,反应原理为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.下列叙述不正确的是( )
A. 氧化剂为Ca(ClO)2,其中Cl元素被还原
B. 若有2molH2O生成,则反应中有2mol电子转移
C. 浓HCl在反应中起酸性和还原性的作用
D. 氧化剂与还原剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
限一种试剂,经过一次性实验就能鉴别Na2CO3 、(NH4)2SO4 、NH4Cl 、KNO3溶液,应选用
A. AgNO3 溶液 B. NaOH溶液 C. Ba(OH)2溶液 D. 盐酸
难度: 中等查看答案及解析
-
把铁和铜加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,反应后铁有剩余则
A.溶液中有Fe2+、Cu2+
B.剩下的固体是Fe和Cu
C.溶液中有Fe3+、Fe2+
D.剩下的固体是Fe,无Cu
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是
A. 春节燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢
难度: 简单查看答案及解析
-
下列物质中含有的杂质(括号内为杂质),不可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Na2O2(Na2O) C.Na2CO3(NaHCO3) D.MgO[Mg(OH)2]
难度: 中等查看答案及解析
-
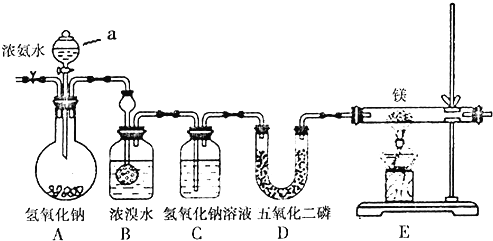
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是
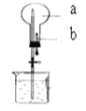
A. a为Cl2气体,b为饱和NaCl溶液
B. a为NH3气体,b为盐酸溶液
C. a为CO2气体,b为浓NaOH溶液
D. a为NO2气体,b为H2O
难度: 简单查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 氯化钙溶液中通入CO2气体: Ca2++H2O+CO2== CaCO3↓+2H+
B. 钠投入CuSO4溶液中:2Na +Cu2+ = Cu + 2Na+
C. NaClO溶液中通入少量的SO2:ClO-+H2O+SO2==Cl-+SO42-+2H+
D. 用三氯化铁溶液回收印刷电路板上的金属铜:Fe3++Cu==Cu2++Fe2+
难度: 简单查看答案及解析
-
在透明的溶液中可以大量共存的离子组是
A. K+、Fe3+、SO32-、I- B. OH-、Ba2+、Na+、NH4+
C. Fe2+、K+、SO42-、NO3- D. HCO3-、NO3-、OH-、K+
难度: 简单查看答案及解析
-
实验室可用如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是
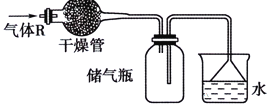
A. NO2 B. NO C. SO2 D. NH3
难度: 中等查看答案及解析
-
下列实验操作、现象正确的是
实验现象
解释
A
KI淀粉溶液中通入Cl2,溶液变蓝
淀粉能与Cl2发生反应
B
胶体的微粒可以透过滤纸,不能透过半透膜
胶体的微粒直径介于1―100nm之间
C
用洁净玻璃棒蘸取溶液进行焰色反应火焰呈黄色
溶液中有Na+、无K+
D
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
是由于该溶液中含有SO42-
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
由钠、镁、铝、锌四种金属单质中的两种组成的合金共11.5g,跟足量的盐酸反应产生11.2L氢气(标准状况),那么此合金中一定含有的金属是( )
A. Al B. Mg C. Na D. Zn
难度: 困难查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. Fe
FeCl2
Fe(OH)2
B. S
SO3
H2SO4
C. CaCO3
CaO
CaSiO3
D. NH3
NO
HNO3
难度: 困难查看答案及解析
-
下列装置所示的实验中,不能达到实验目的是
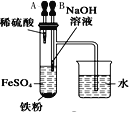
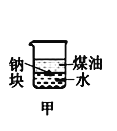
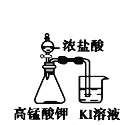
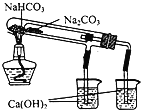
A.长时间看到Fe(OH)2白色沉淀
B.证明ρ(煤油)< ρ(钠) < ρ(水)
C.探究氧化性:
KMnO4>Cl2>I2
D.比较NaHCO3、Na2CO3的热稳定性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在标准状况下,将O2和NO2按1∶4的体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为
A.
mol·L-1 B.
mol·L-1 C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A. ab 段反应是:SO2+ 2 H2S="3S↓+2" H2O
B. 亚硫酸是比氢硫酸更弱的酸
C. 原H2S溶液的物质的量浓度为0.05 mol•L-1
D. b 点对应的溶液导电性最强
难度: 中等查看答案及解析
-
下列有关SO2的性质的探究实验报告记录的实验现象正确的是
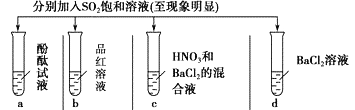
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色溶液
C
无色
无色
白色沉淀
无色溶液
D
红色
无色
白色沉淀
白色溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某100 mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出):
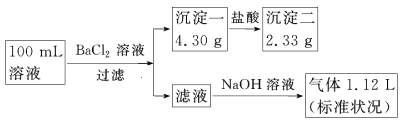
下列说法不正确的是( )
A. 原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B. 原溶液一定存在Cl-,可能存在Na+
C. 原溶液中c(Cl-)≥0.1 mol·L-1
D. 若原溶液中不存在Na+,则c(Cl-)<0.1 mol·L-1
难度: 中等查看答案及解析
-
将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
难度: 中等查看答案及解析