-
下列实验操作、现象及得出的结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
Cu与浓硫酸反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中
溶液变蓝
证明反应生成了Cu2+
B
向KNO3和KOH混合溶液中加入铝粉并加热,管口放置湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液
产生黑色沉淀(Ag2S)
Ksp(Ag2S) >Ksp(Ag2CO3)
D
铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中
铝丝表明变红色
铝可以从铜盐溶液中置换出铜
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 标准状态下560mL的氢气和氯气混合充分反应后共价键数目为0.05NA
B. 标准状态下,将50mL0.01mol/L的NH4Cl溶液与等体积等浓度的NaOH溶液混合,产生气体的分子数为5×10-4NA
C. 常温常压下,1.5 mol HCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D. 0. 1 mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
中华传统文化博大精深,其中涉及到很多的化学知识。下列有关说法中正确的是( )
A. 《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物
B. 成语“刀耕火耨” 蕴含的化学原理是放火烧去野草,用余灰肥田,还可降低土壤碱性
C. 诗句“落红不是无情物,化作春泥更护花”指凋谢的花可以包裹植物的根,对植物有保护作用
D. 西晋刘琨《重赠卢谵》中的诗句“何意百炼钢,化为绕指柔”中包含有化学变化
难度: 简单查看答案及解析
-
某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )
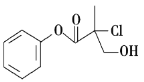
A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
难度: 中等查看答案及解析
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是( )
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. W、X、Q三种元素都能形成多种氧化物
D. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是( )
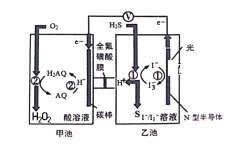
A. 该装置中电能转化为光能
B. 电路中每转移0.2mol电子,甲池溶液质量变化 3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中碳棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
难度: 中等查看答案及解析
-
若用AG表示溶液的酸度,其表达式为:AG=lg[
]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
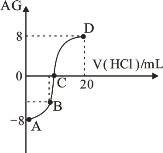
A. 该滴定过程可选择酚酞作为指示剂
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
难度: 困难查看答案及解析
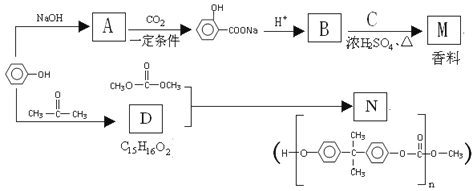
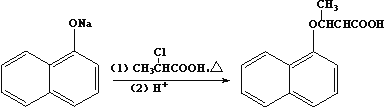 ,写出以苯酚、乙醇和ClCH2COOH为原料制备
,写出以苯酚、乙醇和ClCH2COOH为原料制备