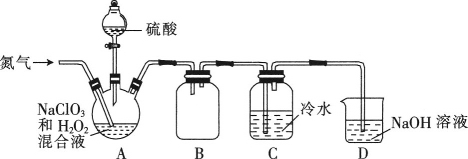
-
中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
难度: 简单查看答案及解析
-
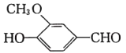
羟甲香豆素(
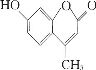 )是一种治疗胆结石的药物,下列说法正确的是
)是一种治疗胆结石的药物,下列说法正确的是A. 分子中的两个苯环都可以发生加成反应
B. 二氯代物超过两种
C. 1mol羟甲香豆素与氢气加成,最多需要5molH2
D. 所有原子均处于同一平面
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA
B. 1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA
C. 5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA
D. 常温下2.24LSO3中含有的质子数为4.0NA
难度: 简单查看答案及解析
-
用下列实验装置进行相应的实验,能达到实验目的的是
A.
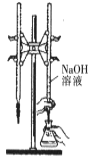 所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验B.
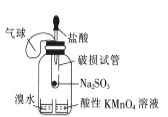 所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性C.
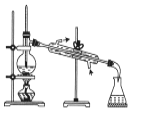 所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物D.
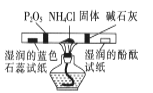 所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体难度: 中等查看答案及解析
-
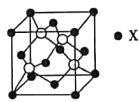
短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有Y为金属元素。W、Y、Z最外层电子数之和为12;W与X、Y与Z分别同周期;X与Z形成的化合物可被氢氟酸腐蚀。下列说法错误的是
A. 常温常压下W的单质为气态 B. Z的氢化物为共价化合物
C. X和Y的原子半径大小:X<Y D. X与Z形成的化合物属于碱性氧化物
难度: 中等查看答案及解析
-
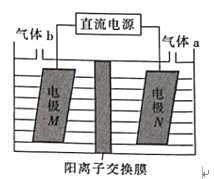
铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为
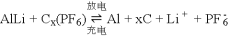 ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是
A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e− = xC + PF6−
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
难度: 中等查看答案及解析
-
下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3•H2O占初始时NH3•H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3•H2O)
难度: 简单查看答案及解析

 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下:
 (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。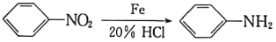 ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯( )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。