-
一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:

下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 石油裂解的主要目的是提高轻质液体燃料的产量和质量
B. 用NaHCO3溶液可以鉴别乙醇、乙酸和苯
C. 棉花和合成纤维的主要成分均为纤维素
D. 淀粉、油脂、甘氨酸在一定条件下都能发生水解反应
难度: 中等查看答案及解析
-
某化学学习小组用如下图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )

A. 用
和浓盐酸制备
时,只选
B.
用于
收集时,a为进气口
C.
中加入NaBr溶液和
,通入
反应后振荡、静置,下层溶液呈橙红色
D.
中通入
使品红溶液褪色后,取出溶液加热可恢复红色
难度: 简单查看答案及解析
-
X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素质子数之和的
.下列说法正确的是( )
A. 简单离子半径:
B. X与Y形成的二元化合物常温下一定为气态
C. W和R形成的化合物是离子化合物
D. Y与W、Z与W形成的二元化合物都是大气污染物
难度: 简单查看答案及解析
-
三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
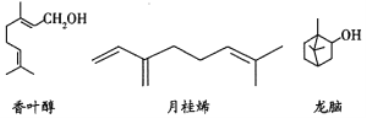
A. 香叶醇和龙脑互为同分异构体,分子式均为
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与
发生加成反应
难度: 简单查看答案及解析
-
石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
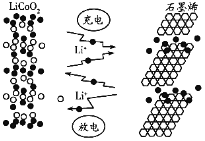
A. 充电时,
嵌入
中
B. 放电时,
极发生的电极反应为
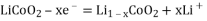
C. 放电时负极反应为:
D. 充电时,若转移
,石墨烯电极增重7g
难度: 中等查看答案及解析
-
常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )
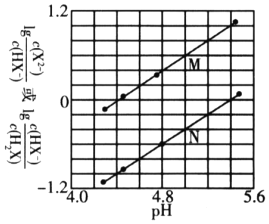
A. 曲线M表示
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,

D.
的数量级为
难度: 中等查看答案及解析
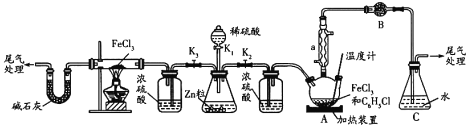
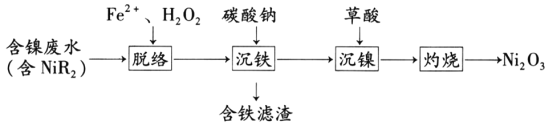
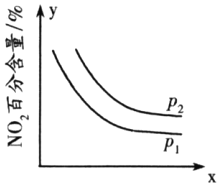
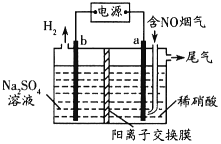
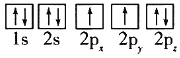

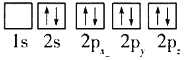

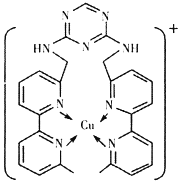
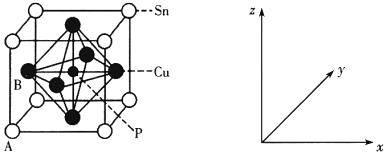
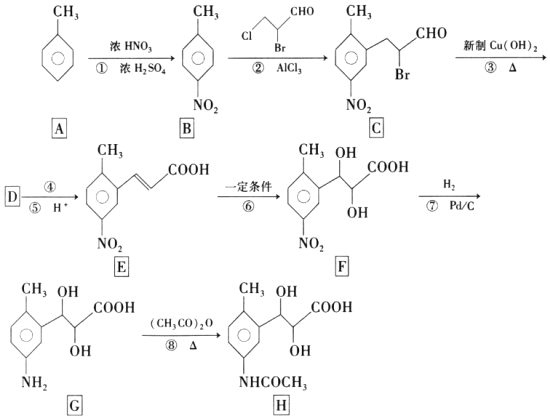
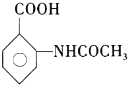 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。