-
下列对于太阳能、生物质能和氢能利用的说法不正确的是
A. 将植物的秸秆、杂草和人畜粪便等加入沼气发酵池中,在富氧条件下,经过缓慢、复杂的氧化反应最终生成沼气,从而有效利用生物质能
B. 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,晚上重新结晶放热,实现了太阳能转化为化学能继而转化为热能
C. 在工农业生产、日常生活中需要大量应用氢能源,但需要解决氢气的廉价制备、氢气的储存和运输等问题
D. 垃圾处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市环境
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 14.2g C10H22中含有共价键总数为3.1NA
C. 标准状况下,将3.36L Cl2通入1L 0.2mol/L FeBr2溶液中,被氧化的Br-数目为0.3NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
难度: 中等查看答案及解析
-
下列有关有机物的叙述错误的是
A. 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
B. 乙苯与异丙苯(
)的一氯代物同分异构体数目相等
C. 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
D. 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否出现砖红色沉淀
难度: 中等查看答案及解析
-
已知短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示。则下列说法正确的是
Y
Z
X
W
A. 原子半径:X<Y<Z
B. W的最高价氧化物对应水化物一定为强酸
C. Y、Z的简单氢化物均易溶于水
D. 非金属性:W>Z>Y
难度: 中等查看答案及解析
-
最近有研究人员发现了一种处理高浓度乙醛废水的新方法——隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是

A. 电解过程中,阴极区消耗Na+
B. 阳极反应为CH3CHO-2e-+2H+==CH3COOH+H2O
C. 电解的总反应方程式为:2CH3CHO+H2O
CH3COOH+CH3CH2OH
D. 若以CH4—空气燃料电池为直流电源,燃料电池的b极应通入空气
难度: 困难查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
证明“84”消毒液的氧化能力随溶液pH的减小而增强
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色
B
证明反应速率会随反应物浓度的增大而加快
用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡
C
证明碳和浓硫酸共热生成的气体中含有二氧化碳
将生成的气体直接通入澄清石灰水,有白色沉淀生成
D
证明氯化银的溶解度大于硫化银的溶解度
向2 mL 0.1 mol•L-1硝酸银溶液中加入1mL 0.1mol•L-1 NaCl溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是
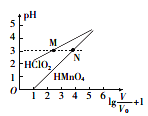
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=lg(V/V0)
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
难度: 中等查看答案及解析