-
分类法在化学发展中起到了非常重要的作用,下列分类标准合理的是
A. 根据是否含有氧元素,将物质分为氧化剂和还原剂
B. 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
C. 根据水溶液是否能够导电,将物质分为电解质和非电解质
D. 根据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
难度: 中等查看答案及解析
-
下列微粒在所给条件下,一定可以大量共存的是( )
A. 透明溶液中:SCN-、NO3-、Na+、Fe3+
B. 遇酚酞显红色的溶液中:Cl2、Mg2+、I-、SO42-
C. 与铝反应能产生大量氢气的溶液中:HCO3-、K+、Cl-、CH3COO-
D. 酸性溶液中:Fe2+、Al3+、SO42-、NH4+
难度: 简单查看答案及解析
-
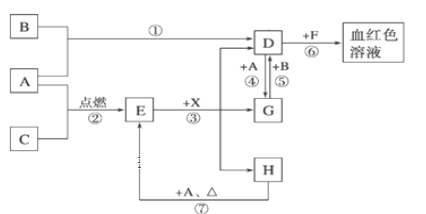
高铁酸钾(K2FeO4)是一种高效的净水剂,可用次氯酸盐氧化法制备,原理如下:
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH.下列说法不正确的是( )
A. 反应①为氧化还原反应,反应②为复分解反应 B. 反应①中Na2FeO4是氧化产物
C. 反应①中氧化剂和还原剂的物质的量之比为2:3 D. 每生成1mol K2FeO4,转移电子的物质的量为3mol
难度: 中等查看答案及解析
-
下列实验现象和结论相符的是( )
操作及现象
结论
A
溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体
溶液中一定含有CO32-
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
某气体通入澄清石灰水,溶液变浑浊
该气体一定是CO2
D
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红
溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学在生产和生活中有重要的应用,下列说法正确的是( )
A. 苏打在生活中可用做发酵粉 B. 磁性氧化铁可用于制备颜料和油漆
C. 石灰石既是制玻璃的原料又是制水泥的原料 D. 二氧化硅可用于制作硅芯片和光电池
难度: 简单查看答案及解析
-
下列试剂保存说法不正确的是( )
A. 金属钠存放在盛有煤油的试剂瓶中 B. 漂白粉置于冷暗处密封保存
C. 存放液溴的试剂瓶中应加水封 D. 烧碱盛放在玻璃瓶塞的磨口玻璃瓶中
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A. 丁达尔效应可以区别溶液和胶体
B. 合金与各组分金属相比一般具有更大的硬度
C. 向醋酸溶液中加入Na2CO3 固体,溶液的导电性明显增强
D. 配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大
难度: 简单查看答案及解析
-
下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸
②向AlCl3溶液中通入过量的NH3
③向Ba(OH)2溶液中通入过量CO2
④向NaAlO2溶液中逐滴加入过量的盐酸
A. ①② B. ①③④ C. ①③ D. ③④
难度: 简单查看答案及解析
-
下列变化的实质相似的是( )
①浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字 ②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使高锰酸钾溶液、溴水褪色 ④氨气和硫化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A. 只有③⑤ B. 只有②③④ C. 只有③④⑥ D. 全部
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. Cl2与水反应:Cl2+ H2O = 2H++ Cl-+ClO-
B. AlCl3溶液中加入过量的氨水:Al3++ 3NH3·H2O = Al(OH)3↓+3NH4+
C. 三氯化铁溶液中加入金属钠:3Na+ Fe3+=3Na+ + Fe
D. NaAlO2溶液中通入过量的CO2:2AlO2-+ CO2+3H2O=2Al(OH)3↓+ CO32-
难度: 简单查看答案及解析
-
《本草衍义
中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( )
A. 蒸馏 B. 升华 C. 蒸发 D. 萃取
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器正确的是( )
选项
A
B
C
D
实验
从食盐水中提取NaCl固体
分离碘和泥沙
分离水和四氯化碳
分离Na2SO4溶液和苯(苯是难溶于水,密度比水小的液体)
装置或仪器
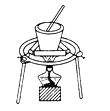
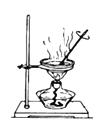
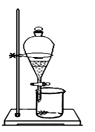
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol Cl2与足量的Ca(OH)2溶液完全反应,转移电子的数目为2NA
B. 60 g SiO2晶体中含有的分子数目为NA
C. 9.2 g NO2和N2O4的混合气体中原子总数为0.6 NA
D. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2 NA
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示物质间转化均能实现的是
A. CaCO3
CaO
CaSiO3
B. Fe
FeCl2
Fe(OH)2
C. Al
H2
Cu
D. S
SO3
H2SO4
难度: 简单查看答案及解析
-
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是

A. a为Cl2气体,b为饱和NaCl溶液
B. a为NH3气体,b为盐酸溶液
C. a为CO2气体,b为浓NaOH溶液
D. a为HCl气体,b为H2O
难度: 简单查看答案及解析
-
下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
难度: 中等查看答案及解析
-
A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )
选项
假设
结论
A
A为NaOH溶液
D可能是CO2
B
B为CO
C可能是CO2
C
C为FeCl2 ,D为Fe
A可能是盐酸
D
C为SO2
A可能是H2S
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
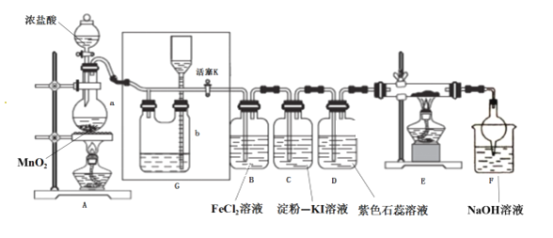
某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
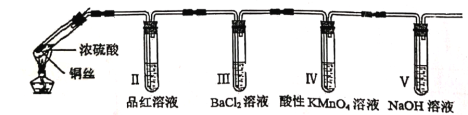
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
难度: 中等查看答案及解析
-
某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )
A. Na+ B. OH- C. Cl- D. SO42-
难度: 简单查看答案及解析
-
向MgCl2、Al2(SO4)3的混合済液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如右图所示,则原溶液中SO42—与Cl—的物质的量之比是( )

A. 1:2 B. 1:1 C. 2:3 D. 3:2
难度: 中等查看答案及解析
-
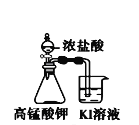
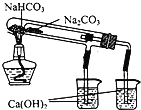
下列装置所示的实验中,不能达到实验目的是
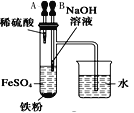
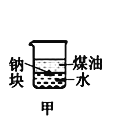
A.长时间看到Fe(OH)2白色沉淀
B.证明ρ(煤油)< ρ(钠) < ρ(水)
C.探究氧化性:
KMnO4>Cl2>I2
D.比较NaHCO3、Na2CO3的热稳定性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
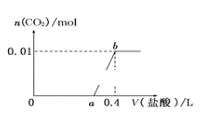
A. 在0~a范围内,只发生中和反应
B. ab斜段发生反应的离子方程式为CO32—+2H+=H2O+CO2↑
C. a=0.2
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为2∶1
难度: 中等查看答案及解析
-
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
难度: 中等查看答案及解析
-
在由NaOH、Na2O2组成的混合物中钠元素的质量分数为58%,则混合物中氢元素的质量分数为( )
A. 62% B. 2% C. 4% D. 无法确定
难度: 简单查看答案及解析