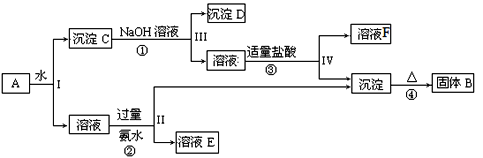
-
下列分散系中,明显与其他不同的一种是( )
A. 盐酸 B. 稀豆浆 C. NaOH溶液 D. FeCl3溶液
难度: 简单查看答案及解析
-
下列根据实验现象所得出的结论中,正确的是
A. 某物质焰色反应呈黄色,说明该物质一定是钠盐
B. 某溶液加NaOH溶液生成蓝色沉淀,说明该溶液中一定含有Mg2+
C. 某无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,说明该溶液中一定含有SO42-
D. 某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明该溶液中一定含有Fe2+
难度: 简单查看答案及解析
-
下列仪器中不能用作反应器的是
A. 容量瓶 B. 锥形瓶 C. 烧杯 D. 蒸发皿
难度: 简单查看答案及解析
-
下列物质变化或操作过程中发生化学变化的是
A. 硅胶作袋装食品的干燥剂 B. 氯气作自来水杀菌消毒剂
C. 用铂丝蘸取碳酸钠溶液在酒精灯外焰上灼烧 D. 用蒸馏的方法除去自来水中的Cl-
难度: 中等查看答案及解析
-
下列有关物质性质与用途不对应的是
A. 明矾能水解产生 Al(OH)3 胶体,可用作净水剂
B. SO2 具有还原性,可用于漂白纸浆
C. 铝锂合金的硬度大,可用作飞机材料
D. 硅酸钠溶液可与 CO2 反应,水玻璃可用于生产粘合剂和防火剂
难度: 中等查看答案及解析
-
现有CO、N2O4两种气体,若它们具有相同的氧原子数,则二者的物质的量之比为
A. 1:4 B. 4:1 C. 2:3 D. 1:1
难度: 中等查看答案及解析
-
下列物质溶于水能导电,但不属于电解质的是
A. 氧化钠 B. 蔗糖 C. 氯气 D. 氯化铁
难度: 简单查看答案及解析
-
下列溶液中,Cl-物质的量最大的是
A. 60 mL 0.3 mol/L的NaCl溶液 B. 20 mL 0.2 mol/L的AlCl3溶液
C. 40 mL 0.2 mol/L的MgCl2溶液 D. 30 mL 0.4 mol/L的KCl溶液
难度: 中等查看答案及解析
-
下列行为符合安全要求的是
A. 用点燃的火柴在液化石油气钢瓶口检验是否漏气
B. 将强酸性洁厕液与漂粉精混合使用以增强清洗效果
C. 有大量氯气泄漏时,应向顺风低洼地区转移,并用湿毛巾护住口鼻
D. 若发生急性CO中毒,应将患者迅速移至空气新鲜的地方实施抢救
难度: 中等查看答案及解析
-
下列反应中,属于氧化还原反应且属于离子反应的是
A. 2Na2O2+2CO2 = 2Na2CO3+O2 B. CO2+Ca(OH)2== CaCO3↓+H2O
C. Fe2O3+3CO
2Fe+3CO2 D. 2Na+2H2O==2NaOH+H2↑
难度: 简单查看答案及解析
-
如图所示装置在化学实验中用途广泛,气体b进a出时能实现下列目的的是
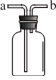
A. 利用排空气法收集NO气体
B. 集气瓶中装满饱和氯化钠溶液收集Cl2
C. 在集气瓶中加入浓硫酸干燥SO2气体
D. 利用排空气法收集CO2气体
难度: 中等查看答案及解析
-
下列各组离子,能在酸性溶液中大量共存的是
A. Fe2+、Al3+、OH-、Cl- B. Ca2+、Na+、CO32-、NO3-
C. K+、Cu2+、SO42-、Cl- D. Na+、OH-、SiO32-、AlO2-
难度: 中等查看答案及解析
-
新制氯水与久置氯水相比较,下列说法错误的是
A. 颜色不同 B. 都能使蓝色石蕊试纸先变红后褪色
C. 都能使滴有酚酞的NaOH溶液褪色 D. 加AgNO3溶液都能生成白色沉淀
难度: 中等查看答案及解析
-
与8 g SO3所含氧原子数相等的CO2的质量为
A. 2.4 g B. 2.2 g C. 4.4 g D. 6.6 g
难度: 中等查看答案及解析
-
下列物质不能通过化合反应制得的是
A. SO2 B. FeCl2 C. Fe(OH)3 D. H2SiO3
难度: 中等查看答案及解析
-
《环境空气质量标准》将PM2.5纳入强制监测指标,迄今为止,中国空气污染物监测指标应包括:①二氧化硫、②一氧化碳、③二氧化氮、④可吸入颗粒物(PM10)、⑤PM2.5。上述5种检测物中,能形成酸雨的是
A. ④⑤ B. ①②③ C. ①③ D. ①②④⑤
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B. Na放入水中,产生气体:Na + H2O=Na+ + OH- + H2↑
C. 向FeCl3溶液中滴加淀粉碘化钾溶液,溶液变蓝:2Fe3+ + 2I-=2Fe2+ + I2
D. NaHCO3溶液与NaOH溶液反应: OH- + HCO3-=CO2 ↑ + H2O
难度: 中等查看答案及解析
-
下列除去杂质(括号内的物质为杂质)试剂选择错误的是
A. FeSO4 (CuSO4):铁粉 B. CO (CO2):NaOH溶液
C. CO2 (HCl):饱和Na2CO3溶液 D. Cu (Fe):稀盐酸
难度: 中等查看答案及解析
-
若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,8 g O2和24 g O3的混合气体中分子总数为2NA
B. 1 mol Na2O2 跟足量H2O反应时得到电子的数目为2NA
C. 常温常压下,18 g H2O所含电子数为10NA
D. 标准状况下,22.4 L四氯化碳所含分子数为NA
难度: 中等查看答案及解析
-
某溶液中含有HCO3-、SO32-、Na+、NO3-四种离子,向其中加入适量Na2O2固体后,假设溶液体积不变,溶液中离子浓度增大的是
A. SO32- B. HCO3- C. Na+ D. NO3-
难度: 中等查看答案及解析
-
在某未知溶液中检验出含有 Ba2+、NO3-的强酸性溶液。某学生还需鉴定此溶液中是否大量存在:①Al3+;②NH4+;③Fe2+;④Cl—;⑤ AlO2— ;⑥SO42-,其实这些离子中有一部分不必再鉴定就能否定,它们是
A. ③⑤⑥ B. ④⑤⑥ C. ①②⑤ D. ①③④
难度: 中等查看答案及解析
-
使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量W和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的物质的量之比为
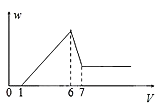
A. 1∶1 B. 2∶3 C. 8∶9 D. 4∶3
难度: 中等查看答案及解析
-
标准状况下,将11.2LCO2 缓缓通入300mL2mol·L-1的NaOH 溶液中,待充分反应后将所得溶液蒸干并充分灼烧,最后所得固体物质的质量为
A. 31.8g B. 53g C. 63.6g D. 84g
难度: 中等查看答案及解析