-
中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载
化学知识
A
《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”
铁的合金硬度比纯铁的大,熔点比纯铁的高
B
《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛”
强水为氢氟酸
C
《本草经集注》中记载鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“强烧之,紫青烟起,云是真硝石也”。
利用焰色反应
D
《诗经•大雅•绵》:“堇荼如饴。”郑玄笺:“其所生菜,虽有性苦者,甘如饴也。”
糖类均有甜味
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法错误的是
A. 11.2 L 甲烷和乙烯的混合物中含氢原子数目等于2NA
B. 含NA个 CO32-的 Na2CO3溶液中,Na+数目大于2NA
C. 密闭容器中,2 molSO2和足量 O2充分反应,产物的分子数小于2NA
D. 4.0 g CO2气体中含电子数目等于2NA
难度: 中等查看答案及解析
-
某学习小组以废催化剂(主要成分SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:
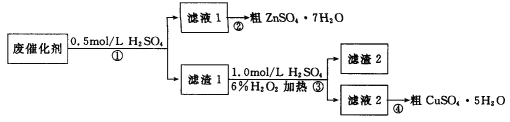
下列说法正确的是
A. 步骤①中能溶于稀硫酸的是ZnO、ZnS和CuS
B. 步骤①、③中发生的反应均为氧化还原反应
C. 步骤③涉及的离子反应可能为CuS+H2O2+2H+
Cu2++S+2H2O
D. 步骤②和④,采用蒸发结晶,过滤后均可获取粗晶体
难度: 中等查看答案及解析
-
二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如下图所示。下列有关二异丙烯基苯的说法错误的是
A. 在催化剂存在下可发生加聚反应
B. 与溴水混合后加入铁粉可发生取代反应
C. 分子中所有碳原子可能都处于同一平面
D. 其一氯代物有5种
难度: 中等查看答案及解析
-
下列实验操作、实验现象和实验结论均正确的是
选项
实验操作
实验现象
实验结论
A
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液
溶液变红
稀硫酸能氧化Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有氧化性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O能大量共存
D
向1 mL 0.1 mol·L-1 Na2S溶液中滴入2 mL 0.1 mol·L-1 ZnSO4溶液,再加入0.1 mol·L-1 CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
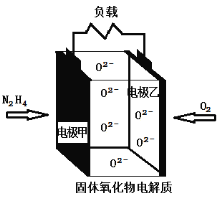
A. 电池总反应为:N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4LO2参与反应
D. 电池正极方程式为:O2 + 4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
若定义pC是溶液中微粒物质的量浓度的负对数,则常温下一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是
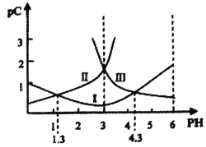
A. 0.1 mol/L的NaHA溶液显碱性
B. 常温下,该酸的电离常数Ka2=10-4.3
C. 常温下,c(H2A)+c(HA-)+c(A2-)是定值
D. 常温下,pH=3时,c(HA-)=c(A2-)
难度: 中等查看答案及解析
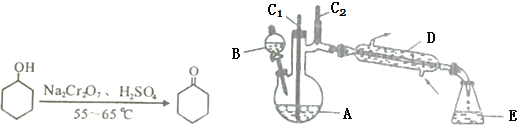

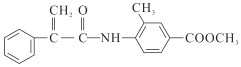 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示: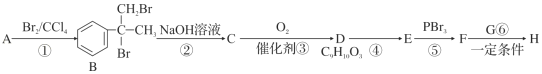
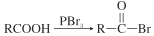 (R为烃基)
(R为烃基)