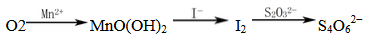-
下列有关物质性质与用途具有对应关系的是
A. Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 中等查看答案及解析
-
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
难度: 中等查看答案及解析
-
下列有关物质应用的说法正确的是( )
A. 铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品
B. 硝酸与铁发生化学反应,不可用铁制容器盛装浓硝酸
C. 碳酸钠溶液呈碱性,可用热的纯碱溶液除去油脂
D. H2与Cl2光照发生爆炸,工业上不能用H2与Cl2做原料生产HCl
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1mol•L﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
难度: 中等查看答案及解析
-
下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH
+2H2O===NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O===2AlO
+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基:
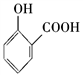 +2HCO
+2HCO→
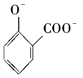 +2H2O+2CO2↑
+2H2O+2CO2↑D. 用高锰酸钾标准溶液滴定草酸:2MnO
+16H++5C2O
===2Mn2++10CO2↑+8H2O
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.用两个铜电极电解食盐水:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B.腐蚀法制作印刷线路板:Fe3++Cu
Fe2++Cu2+
C.CA(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-
CaCO3↓+H2O
D.AlCl3溶液呈酸性的原因:Al3++3H2O
Al(OH)3+3H+
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B.
=1×10-12的溶液中:K+、Na+、CO
、NO
C. c(Fe2+)=1 mol·L-1的溶液中:K+、NH
、MnO
、SO
D. 能使甲基橙变红的溶液中:Na+、NH
、SO
、HCO
难度: 困难查看答案及解析
-
锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中C(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列化学用语表述正确的是( )
A. “84”消毒液中有效成分NaClO的电子式:
B. 乙烯的结构简式:CH2CH2
C. 聚丙烯的结构简式:
D. 电解时铁作阳极的电极反应式:Fe一3e-=Fe3+
难度: 中等查看答案及解析
-
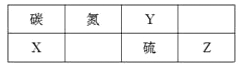
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21。下列关系正确的是
W
X
Y
Z
A. 氢化物沸点:W<Z B. 氧化物对应水化物的酸性:Y>W
C. 化合物熔点:Y2X3<YZ3 D. 简单离子的半径:Y<X
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W-的最外层为8 电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y ,Z>W
C. 化合物Z2Y 和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 困难查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A. 简单离子半径:W<X<Z B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( )
A、Zn为电池的负极
B、正极反应式为:2FeO42- + 10H+ +6e- =Fe2O3 +5H2O
C、该电池放电过程中电解质溶液浓度不变
D、电池工作时OH- 向负极迁移
难度: 困难查看答案及解析
-
如图所示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是

A. C2H4(气) B. CH4 C. CO2 D. NO
难度: 中等查看答案及解析