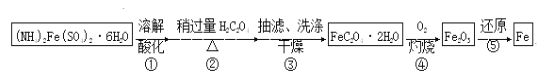
-
化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 《本草经集注》对“消石”的注解如下:“……如握雪不冰。强烧之,紫青烟起,仍成灰……”。这里的“消石”指的是高锰酸钾
D. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指蒸馏
难度: 简单查看答案及解析
-
下列反应的离子方程式书写不正确的是( )
A. 向氯化铝溶液中加入过量的氨水:Al3++3NH3·H2O= Al(OH)3↓+3NH4+
B. 用氨水吸收过量的二氧化硫:NH3·H2O+SO2 = NH4+ +HSO3-
C. 向偏铝酸钠溶液中加入过量的稀盐酸:AlO2-+H++H2O= Al(OH)3↓
D. 向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO +CO32-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 100 g溶质质量分数为46%的乙醇水溶液中,含有4NA个氧原子
B. 1 mol Cl2溶于水,溶液中Cl-、HClO、ClO-粒子数之和小于2NA
C. 2.24 L(标准状况)2H2中含有0.2NA个中子
D. 25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+
难度: 中等查看答案及解析
-
下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D.
的一溴代物有5种
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X的一种核素在考古时常用来鉴定一些文物的年代,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A. 化合物XZ2各原子均满足8电子的稳定结构
B. 已知含氧酸的酸性:H2ZO3>H2XO3,则Z的非金属性强于X
C. 若单质W失火,不能用泡沫灭火器扑灭
D. 通常采用电解法制备单质Y及其同周期的金属单质
难度: 中等查看答案及解析
-
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )
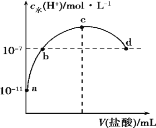
A. 常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
难度: 困难查看答案及解析
-
下列实验方案不能达到实验目的的是
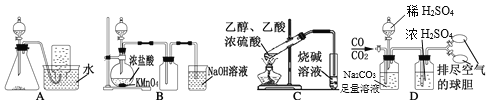
A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
难度: 中等查看答案及解析
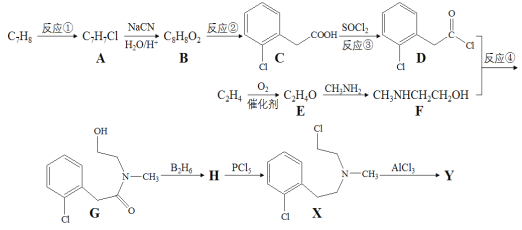
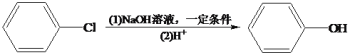
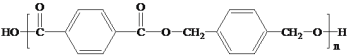 的线路图。___________
的线路图。___________