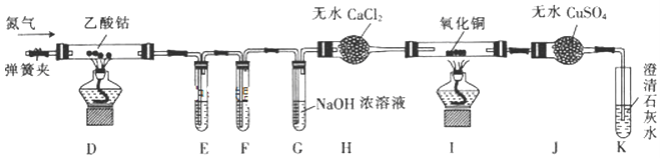
-
设阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 0.1mol氧气与2.3g金属钠充分反应,转移的电子数为0.4NA
B. 加热时, 6.4g铜粉与足量浓硫酸反应,转移的电子数为0.2NA
C. 将0.1mol乙烷和0.1molCL2混合光照,生成一氯乙烷的分子数为0.1NA
D. 0.2mol/L的NaAlO2溶液中AlO2-的数目小于0.2NA
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。W的单质与水发生剧烈反应,生成一种酸和一种气体,X的一种单质(X4)在常温下容易自燃。下列叙述正确的是
A. 单质的沸点:X<Z B. 简单离子的还原性:Y<Z
C. 最简单氢化物的热稳定性:Z>W D. 化合物Y2Z2中含非极性共价键
难度: 简单查看答案及解析
-
下列实验目的、实验操作及推论均正确的是
选项
实验目的
实验操作及推论
A
配制1.84mol/L的硫酸
用酸式滴定管量取25.00mL 18.4mol/L硫酸,加入250mL容量瓶中,加水定容至刻度线
B
检验淀粉分子的直径
用聚光束照射淀粉溶液看到一条光亮的通路,可推测淀粉分子的直径大于10-7m
C
检验某无色溶液中是否含有I-
向该无色溶液中滴加氯化铁溶液和四氯化碳,振荡后静置,下层呈紫色,可确定原溶液中含有I-
D
证明二氧化硫具有还原性
将二氧化硫通入氨水和BaCl2的混合溶液中,有白色沉淀生成
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列说法正确的是
A. 聚乙烯、油脂和蛋白质均属于有机高分子
B. 生物柴油的成分为液态烃的混合物,属于油脂
C. HgCl2可用作防腐剂和杀菌剂,是因为它能使蛋白质发生变性
D. 大量生产和使用活性炭防PM2.5口罩应对雾霾属于“绿色化学”范畴
难度: 简单查看答案及解析
-
研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
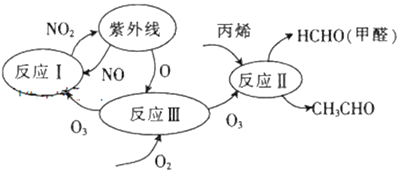
A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
难度: 简单查看答案及解析
-
一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
难度: 中等查看答案及解析
-
25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=10‑4.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
难度: 中等查看答案及解析