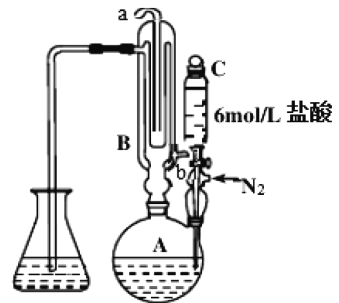
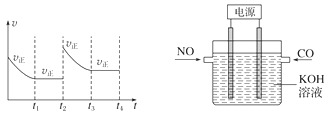
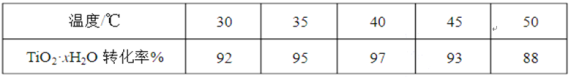
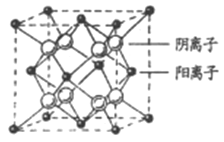
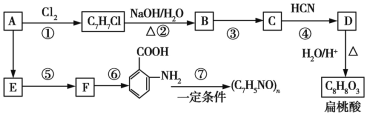
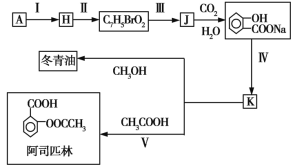
-
下列有关物质变化和分类的说法正确的是
A. 胆矾、冰水混合物、四氧化三铁都不是混合物
B. 电解熔融态的Al2O3、12C转化为14C都属于化学变化
C. “滴水石穿,绳锯木断”不包含化学变化
D. SiO2、NO2、SO2都属于酸性氧化物
难度: 简单查看答案及解析
-
用 表示NA表示阿伏加德罗常数,下列说法正确的是
① 18gD2O 含有的电子数为 10 NA;② 1mol Na2O2与水完全反应时转移电子数为2NA ;③ 12g石墨烯(单层石墨)中含有六元环的个数为 0.5NA;④在标准状况下,22.4LSO3的物质的量为1mol;⑤ 7.8g过氧化钠中含有的离子数为 0.3NA;⑥ 28g硅晶体中含有 2NA个 Si-Si 键;⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是 NA;⑧ 在常温常压下,0.1mol 铁与 0.1molCl2 充分反应,转移的电子数为 0.3NA;⑨标准状况下,22.4LNO和 11.2LO2混合后气体的分子总数为 1.5NA;⑩ S2和 S8的混合物共 6.4g,其中所含硫原子数一定为 0.2NA
A. ①③⑤⑧ B. ②④⑥⑦ C. ③⑤⑥⑩ D. ⑤⑧⑨⑩
难度: 困难查看答案及解析
-
关于有机物

的说法正确的是
A. a、b互为同系物
B. c中所有碳原子可能处于同一平面
C. a、b、c均能使酸性高锰酸钾溶液褪色
D. b的同分异构体中含有羧基的结构还有7种(不含立体异构)
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
证明反应速率会随反应物浓度的增大而加快
用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·L−1CuSO4溶液,迅速产生较多气泡
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红
C
证明“84”消毒液的氧化能力随溶液pH的减小而增强
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色
D
证明氯化银的溶解度大于硫化银的溶解度
向2mL 0.1mol·L−1硝酸银溶液中加入1mL 0.1
mol·L−1 NaCl溶液,出现白色沉淀,再加入几滴0.1mol·L−1的Na2S溶液,有黑色沉淀生成
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
锂离子电池已经成为应用最广泛的可充电电池,下图为某种锂离子电池放电时有关离子转化关系。下列有关说法正确的是

A. 电池中Li+透过膜两侧的电解质可以互换
B. 充电时,Li+通过Li+透过膜从右侧向左侧移动
C. 充电时,钛电极作阴极,电极反应式为:Fe3++e−===Fe2+
D. 放电时,进入贮罐的液体发生的离子反应方程式为:S2O82-+Fe2+===Fe3++2SO42-
难度: 中等查看答案及解析
-
已知:pBa=-lgc(Ba2+),pKa=-lgc(Ka)。已知常温下H2CO3:pKa1=6.4,pKa2=10.3。向20mL 0.1mol·L−1 BaCl2溶液中滴加0.2mol·L−1 Na2CO3溶液的滴定曲线如图所示。下列说法正确的是
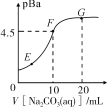
A. E、F、G三点的Ksp从大到小的顺序为:G>F>E
B. 其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移
C. 常温下,Ksp(BaCO3)≈1.0×10−9
D. 常温下,Na2CO3溶液的pKh1=7.6
难度: 中等查看答案及解析
-
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L−1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是
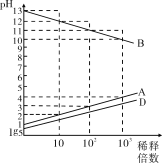
A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
难度: 中等查看答案及解析