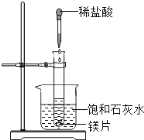
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A. 元素的非金属性次序为c>b>a B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物 D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. Z、W均可与Mg形成离子化合物
D. 最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
据报道,2012年俄罗斯科学家合成了117号元素,在实验中生成了6个新原子,其中5个
、1个
。下列关于
和
的说法不正确的是( )
A.
和
是两种核素
B.
和
互为同位素
C.
和
的中子数分别为176和177
D.
和
的电子数相差1
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
难度: 中等查看答案及解析
-
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )
A. X能形成化学式为X(OH)3的碱 B. X能与某些金属元素形成化合物
C. X原子的最外层电子数和核电荷数肯定为奇数 D. X可能形成化学式为KXO3的盐
难度: 中等查看答案及解析
-
已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n。该化合物中一个R微粒的核外电子数为a,核内中子数b,则该同位素的原子符号是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A. 硫原子的原子结构示意图:
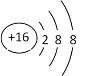
B. NH4Cl的电子式为:
C. 原子核内有10个中子的氧原子:
D. HBr的形成过程:
难度: 中等查看答案及解析
-
已知X、Y、Z都是短周期元素,它们的原子序数依次增大,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
A. Y和Z可以组成一种Y和Z的质量比为7∶8的化合物
B. X、Y、Z可以组成一种盐
C. X和Z可以组成原子个数比分别为1∶1和2∶1常温下呈液态的两种化合物
D. 由X、Y、Z三种元素中的任意两种组成的10电子微粒有2种
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A. 单质的沸点:W>X B. 阴离子的还原性:W>Z
C. 氧化物的水化物的酸性:Y<Z D. X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应又是放热反应的是( )
①过氧化钠与水反应 ②氨水与稀硫酸的反应
③灼热的炭与CO2反应④Ba(OH)2⋅8H2O与NH4Cl的反应
⑤甲烷在O2中的燃烧 ⑥灼热的炭与水蒸气反应
⑦铝片与稀硫酸反应 ⑧铝热反应
⑨煅烧石灰石制生石灰 ⑩钾与水的反应
A. ①⑤⑦⑧⑩ B. ①③⑤⑦⑩ C. ①②⑤⑦⑧⑩ D. ①③⑤⑥⑦⑩
难度: 中等查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气放出热量时放出的热量121kJ,且氧气中1 molO=O键完全断裂时吸收热量496kJ,氢气中1mol H−H键断裂时吸收热量436kJ,则水蒸气中1mol H−O键形成时放出热量为( )
A. 920 kJ B. 557 kJ C. 221 kJ D. 463 kJ
难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为( )
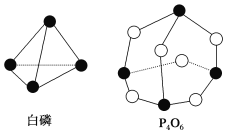
A. -1638kJ/mol B. +1638kJ/mol C. -126kJ/mol D. +126kJ/mol
难度: 中等查看答案及解析
-
下图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( )
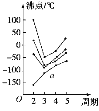
A. H2S B. HCl C. PH3 D. SiH4
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是( )
A. 1 mol由元素A、B组成的化合物一定含有18 mol e-
B. 元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C. C与A形成的化合物肯定是离子化合物
D. 化合物AE与CE含有相同类型的化学键
难度: 中等查看答案及解析
-
下列组合中关于卤素的叙述全部正确的是( )
①卤素只以化合态存在于自然界中 ②随核电荷数增加,单质熔沸点降低
③随核电荷数增加,单质氧化性增强 ④随核电荷数增加,气态氢化物稳定性逐渐增强
⑤易形成-1价离子 ⑥从上到下原子半径逐渐减小
⑦从上到下非金属性逐渐减弱
A. ①③⑤ B. ①⑤⑦ C. ②⑥⑦ D. ①②④
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是( )
① 含有金属元素的化合物一定是离子化合物
② 第ⅠA族和第ⅦA族原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 含有离子键的化合物一定是离子化合物
⑥ 离子化合物中可能同时含有离子键和共价键
A. ①②⑤ B. ④⑤⑥ C. ①③④ D. ②③⑤
难度: 中等查看答案及解析