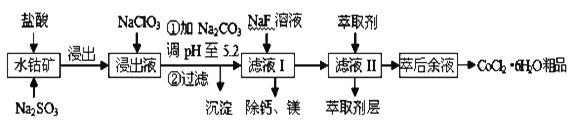
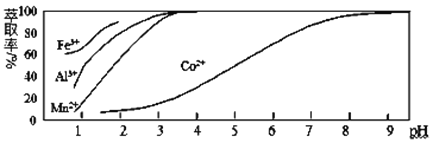
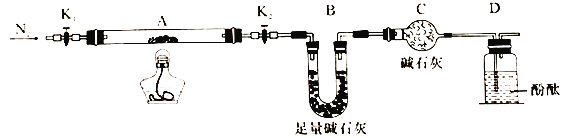
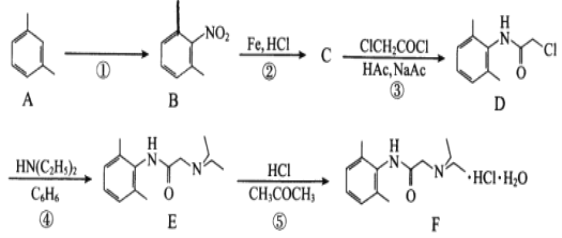
-
短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X、Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性。下列说法正确的是( )
A. 离子半径由大到小的顺序为R、Z、Y、W
B. X、Y分别与Z形成的多种化合物中化学键类型相同
C. Y、R分别与X形成的化合物沸点依次升高
D. Z、W、R最高价氧化物对应的水化物两两之间均能发生反应
难度: 中等查看答案及解析
-
2018年是“2025中国制造”启动年,而化学与生活生产社会可持续发展密切相关。下列有关化学知识的说法错误的是( )
A. “玉兔二号”月球车底盘和车轮由SiC颗粒增强铝基复合材料制成,这是由于该复合材料具有重量轻、高刚度、高耐磨、耐冲击的特点
B. 我国发射的“北斗组网卫星”所使用的碳纤维,是一种非金属材料
C. 高纯二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. 钾一钠合金可用于原子反应堆的导热剂,钾与钠都属于短周期主族元素
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A. 25℃,pH=13的Ba(OH)2溶液中OH-数目为0.1NA
B. 常温常压下,22.4L Cl2和5.6gFe充分反应转移电子数目为0.3 NA
C. 8.0gCu2S和CuO的混合物中所含的铜原子数为0.1 NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
难度: 中等查看答案及解析
-
25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸
HCOOH
HClO
H2S
电离平衡常数(Ka)
Ka=1.0×10-4
Ka=2.0×10-8
Ka1=1.3×10-7
Ka2=7.1×10-15
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向某溶液中滴加H2O2 溶液,再滴加KSCN溶液
溶液变为血红色
原溶液中一定含有Fe2+
B
向H2S 溶液中通入O2
溶液变浑浊
氧化性:O2 >S
C
向等浓度的碳酸氢钠溶液和碳酸钠溶液中分别滴加2滴酚酞溶液
后者红色更深
水解程度:碳酸氢钠>碳酸钠
D
向1mol/L Na2S 溶液中滴加0.1mol/L ZnSO4 溶液至不再产生沉淀,继续滴加0.1mol/L CuSO4
白色沉淀变为黑色
Ksp(CuS)>Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
第20届中国国际工业博览会上,华东师范大学带来一种“锌+碘”新型安全动力电池,亮相工博会高校展区。“锌+碘”新型安全动力电池有望取代目前广泛使用的“铅蓄电池”、“锂电池”等,已知该电池的工作原理如图所示。下列有关说法错误的是
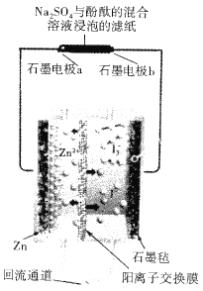
A. 该电池安全性高,且对环境友好
B. 正极反应式为I3-+2e-=3I-,电极a附近显红色
C. 电子的移动方向为“Zn→电极a→电极b→石墨毡”
D. “回流通道”可以减缓电池两室的压差,避免电池受损
难度: 中等查看答案及解析
-
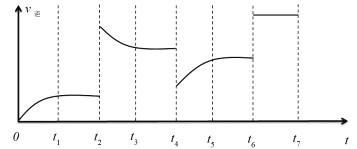
25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。下列说法不正确的是
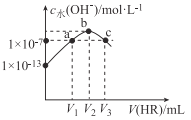
A. V2=10
B. HR为弱酸
C. 当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)
D. 当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)
难度: 中等查看答案及解析