-
在酸性无色溶液中能大量共存的离子组是的是
A. NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl-
D. Na+ 、Ca2+、Cl -、CO32-
难度: 中等查看答案及解析
-
党的十九大报告中提出:大力度推进生态文明建设,全党全国贯彻绿色发展理念的自觉性和主动性显著增强忽视生态环境保护的状况明显改变。建设生态文明是中华民族永续发展的千年大计。必须树立和践行绿水青山就是金山银山的理念。下列关于绿地作用和保护说法中错误的是
A. 绿地可以保持水土,减少水土流失
B. 绿地可以调节气候,减少空气中PM2.5含量
C. 绿地可以吸收二氧化碳,转化生成氧气
D. 为减少园林绿地中病虫害,大量使用杀虫剂解决问题
难度: 简单查看答案及解析
-
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A. 3CO+Fe2O3
2Fe+3CO2
B. Fe+CuSO4=FeSO4+Cu
C. AgNO3+NaCl=AgCl↓+NaNO3
D. 2KMnO4
K2MnO4+MnO2+O2↑
难度: 简单查看答案及解析
-
下列分类或归类正确的是
①盐酸、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质
④火碱、纯碱、碳酸钙都是电解质
⑤碘酒、淀粉、云雾、纳米材料均为胶体
A. ①③④ B. ②③ C. ②④ D. ②③④⑤
难度: 简单查看答案及解析
-
下列属于胶体区别于其它分散系的本质的是
A. 胶体的分散质能透过滤纸 B. 胶体粒子直径在1nm~100 nm之间
C. 胶体具有丁达尔现象 D. 胶体和其它分散系都是混合物
难度: 简单查看答案及解析
-
等量的金属铝与足量的盐酸和氢氧化钠反应,生成的气体
A. 与酸反应放出的多 B. 与碱反应放出的多 C. 无法判断 D. 一样多
难度: 简单查看答案及解析
-
实验操作的规范是实验的基本要求。下列实验操作正确的是
A. 点燃酒精灯
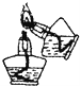
B. 沉淀的过滤
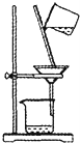
C. 石油的分馏
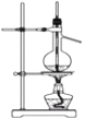
D. NaCl固体的称量
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. Na2CO3=2Na++CO32- B. Ba(OH)2=Ba2++OH-
C. H2SO4=H22++SO42- D. KNO3=K++N5++3O2-
难度: 简单查看答案及解析
-
只用一种试剂就能鉴别出AgNO3、Na2SO4、Na2CO3三种溶液,应选用
A. BaCl2 B. NaOH C. HCl D. NaCl
难度: 简单查看答案及解析
-
中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应如下:TiC14+2Mg
Ti+2MgCl2,下列有关该反应的说法正确的是
A. TiCl4是还原剂 B. Mg被氧化
C. TiCl4发生氧化反应 D. MgCl2是还原产物
难度: 简单查看答案及解析
-
科学家指出:多种海产品如虾、蟹、牡蛎等体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C=砒霜(As2O3)”,下面有关解释正确的是
A. 维生素C具有还原性 B. 维生素C具有氧化性
C. 该反应中+5价砷被氧化 D. 砒霜中毒后可服用维生素C解毒
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A. 含金属元素的离子一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
下列物质属于电解质的是
A. 氨气 B. Br2 C. BaSO4 D. 氢氧化钠溶液
难度: 简单查看答案及解析
-
下列溶液中Cl-的物质的量浓度与200mL1mol/LBaCl2溶液中Cl-的物质的量浓度相同的是
A. 100mL2mol/LMgCl2溶液 B. 200mL2mol/LNaCl溶液
C. 250mL1mol/LAlCl3溶液 D. 100mL2mol/LKClO3溶液
难度: 简单查看答案及解析
-
将一小块金属钠投入下列溶液中,既能产生气体又会出现沉淀的是
A. 稀硫酸 B. 稀氢氧化钠溶液 C. 硫酸铜溶液 D. 氯化铵溶液
难度: 简单查看答案及解析
-
将碘水中的碘萃取出来的实验中,下列说法不正确的是
A. 分液漏斗使用前要检漏
B. 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液
C. 萃取剂要求不溶于水,且碘在萃取剂中溶解度更大
D. 若用CCl4作萃取剂,则分层后下层液体呈紫红色
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 2.4gMg变为Mg2+时失去的电子数目为0.1NA
B. 标准状况下,2.24LH2O含有的分子数目为0.1NA
C. 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
D. 1.0mol·L-1的Na2CO3溶液中含有的Na+数目为2NA
难度: 简单查看答案及解析
-
在下列各反应中,盐酸既表现出酸性又表现出还原性的是( )
A. HCl+NaOH===NaCl+H2O
B. Zn+2HCl===ZnCl2+H2↑
C. HCl+AgNO3===AgCl↓+HNO3
D. MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
难度: 简单查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
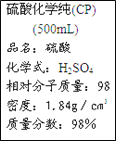
A. 该硫酸试剂的物质的量浓度为18.4
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制50.0mL4.60mol/L的稀硫酸需取该硫酸12.5mL
D. 2.4gMg与足量的该硫酸反应得到H2的体积为2.24L
难度: 中等查看答案及解析
-
下列除杂试剂及操作正确的是
物质
所含杂质
选用的试剂
操作方法
A
CO2
CO
O2
加热
B
KCl
K2CO3
稀H2SO4
加热
C
Cu(OH)2
CuSO4
Ba(OH)2溶液
过滤
D
Fe(NO3)2溶液
AgNO3溶液
足量铁粉
过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 氢氧化钡和稀硫酸反应:Ba2++SO42-=BaSO4↓
B. 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
C. 铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+
D. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 困难查看答案及解析
-
全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好使VO2+→VO2+,Cr2O72-→Cr3+。再滴入2.00mL0.02000mol/L的KMnO4溶液,又恰好使VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+。则原溶液中Cr元素的质量为
A. 15.6mg B. 23.4mg C. 31.2mg D. 46.8mg
难度: 简单查看答案及解析