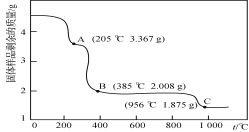
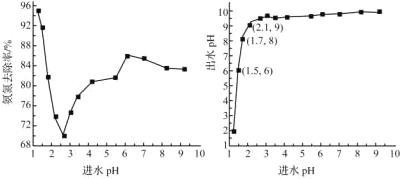
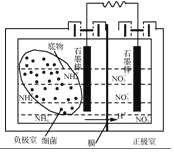
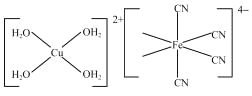
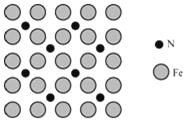
-
工业废水处理达标后才能排放。下列处理废水的方法合理的是( )
A. 用沉淀法除去废水中的H+ B. 用氧化法除去废水中的Al3+
C. 用吸附法除去废水中的悬浮物 D. 用中和法除去废水中的油类物质
难度: 简单查看答案及解析
-
用化学用语表示CH4+Cl2
CH3Cl+HCl中的相关微粒,其中正确的是( )
A. 中子数为20的氯原子:
B. HCl的电子式:H∶Cl
C. CH4的结构式:CH4 D. Cl的结构示意图:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. 浓硫酸具有吸水性,可用于干燥O2
B. SO2具有氧化性,可用于漂白纸浆
C. Fe2O3能与酸反应,可用于制作红色涂料
D. Al(OH)3能与NaOH溶液反应,可用于治疗胃酸过多
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L-1的氨水:Cu2+、Na+、SO42-、NO3-
B. 0.1 mol·L-1的CaCl2溶液:Na+、K+、Cl-、NO3-
C. 0.1 mol·L-1的Na2SO3溶液:K+、H+、SO42-、NO3-
D. 0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO3-、OH-
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的是( )
A. 用
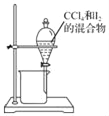 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物B. 用
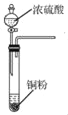 所示装置获取少量SO2气体
所示装置获取少量SO2气体C. 用
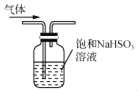 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2D. 用
 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体难度: 中等查看答案及解析
-
下列有关物质性质的叙述不正确的是( )
A. 硝酸见光分解生成NO2、O2和H2O B. 细铁丝在氯气中燃烧生成FeCl2
C. 加热时,钠与氧气反应能生成Na2O2 D. 放电时,氮气与氧气反应生成NO
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,Y的原子序数是W的2倍,Z与X形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )
A. Z的氧化物的水化物的酸性比Y的强
B. 氢元素与W只能形成一种化合物
C. W的简单离子的半径比X的大
D. Y的简单气态氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SO2
CaSO3
CaSO4
B. Fe
Fe2O3
FeCl3
C. HCl(aq)
Cl2
Ca(ClO)2
D. Cu2(OH)2CO3
CuO
CuCl2(aq)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
难度: 中等查看答案及解析
-
化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
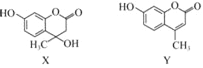
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊
蛋白质可能发生了变性
B
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
C
室温下,用pH试纸测得:0.1 mol•L﹣1Na2SO3溶液的pH约为10;0.1 mol•L﹣1NaHSO3溶液的pH约为5
HSO3﹣结合H+的能力比SO32﹣的强
D
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)<Ksp(AgCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
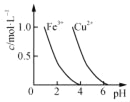 若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右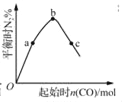 表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a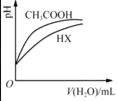 表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数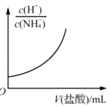 表示25℃时,向0.1 mol•L﹣1的NH4Cl溶液中滴加0.1 mol•L﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
表示25℃时,向0.1 mol•L﹣1的NH4Cl溶液中滴加0.1 mol•L﹣1的盐酸,溶液中c(H+)/c(NH4+)随盐酸体积的变化关系
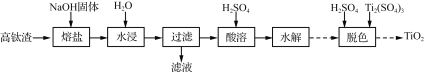
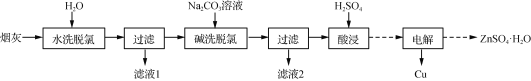
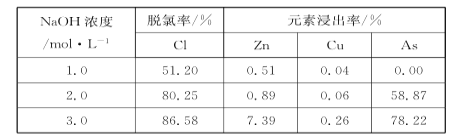
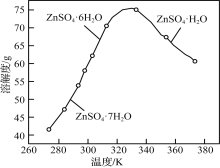
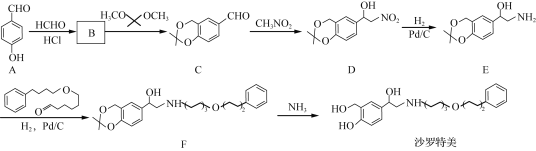
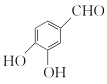 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备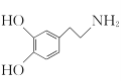 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。