-
将一定量的SO2通人FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是
选项
操作
现象
A
加入NaOH溶液
有红褐色沉淀
B
加入Ba(NO3)2溶液
有白色沉淀
C
加入3酸性KMnO4溶液
紫色褪去
D
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
春秋时期齐国的官书《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体来洗涤丝帛。这种液体能洗涤丝帛主要是因为其中含有( )
A. 氢氧化钾 B. 碳酸钠 C. 氧化钙 D. 次氯酸钠
难度: 中等查看答案及解析
-
下列说法正确的是
A. 泡沫灭火器中的Al2(SO4)3溶液贮存在钢筒内
B. 乙醇和双氧水都可用于消毒,二者消毒原理相同
C. 太阳能电池板的材料是二氧化硅
D. 工业生产玻璃、水泥漂白粉,均需要用石灰石作原料
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:
B. 乙醇的结构筒式:
C. COCl2的结构式为:
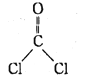
D. CaO2的电子式为:
难度: 中等查看答案及解析
-
下列工业生产的过程中,未涉及氧化还原反应的是
A. 粗铜精炼 B. 海水提镁 C. 工业制铝 D. 海水制粗盐
难度: 中等查看答案及解析
-
下列有关金属及其化合物的说法正确的是,
A. 钠在空气中燃烧生成白色固体Na2O2
B. Mg在空气中燃烧,其生成物只有MgO
C. 铁在高温下与水蒸气反应生成Fe3O4和H2
D. 铝、铁、铜在潮湿的空气中易生锈生成对应的氧化物
难度: 中等查看答案及解析
-
根据侯氏制碱原理,实验制备少量的Na2CO3,依次经过制取氨气.制取NaHCO3、分离NaHCO3、分解NaHCO3四个步骤。下列图示装置和原理正确的是
A. 制取氨气
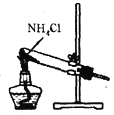 B. 制取NaHCO3
B. 制取NaHCO3
C. 分离NaHCO3
 D. 分解NaHCO3
D. 分解NaHCO3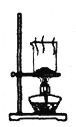
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 常温常压下,30g乙烷气体中所含有的共价键数目为6NA
B. 常温下,100mL0.1mol/L NH4Cl溶液中含有NH4+数目为0.01NA
C. 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2 NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2 NA
难度: 中等查看答案及解析
-
水杨酸冬青油、阿司匹林的结构简式如图,下列说法不正确的是
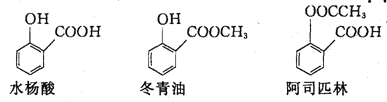
A. 由水杨酸制冬青油的反应是取代反应
B. 阿司匹林的分子式为C9H8O4,在一定条件下水解可得水杨酸
C. 冬青油苯环上的一氯取代物有4种
D. 可用NaOH溶液除去冬青油中少量的水杨酸
难度: 中等查看答案及解析
-
分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略)。其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是

A. 原子半径的大小m>q>n>p
B. 元素非金属性q>n>p
C. Q的溶液可以保存在细口玻璃试剂瓶
D. n的氧化物的水化物一定为强酸
难度: 困难查看答案及解析
-
中国是茶的故乡,为方便饮用,可通过以下方法制取罐装饮料茶,有关下述过程说法不正确的是
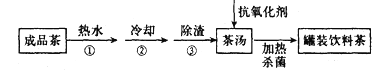
A. 操作①利用了物质的溶解性
B. 操作③的方法属于过滤
C. 加热杀菌的温度应在500°C左右
D. 抗氧化剂的作用是延长饮料茶的保质期
难度: 中等查看答案及解析
-
用无机矿物资源生产部分材料,其产品流程示意图如下:
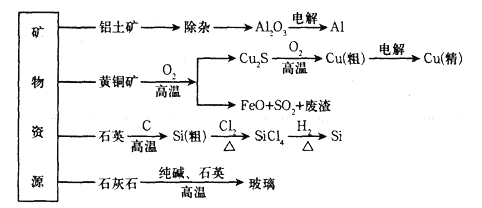
下列有关说法不正确的是
A. 制取粗硅时生成的气体产物固态时可用于人工降雨
B. 生产铝、铜、高纯硅过程中均涉及氧化还原反应
C. 黄铜矿冶炼铜时产生的副产物,可用于生产硫酸和冶铁
D. 玻璃与水泥-样,主要成分都是硅酸盐
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是

A.①③ B.②③ C.②④ D.①④
难度: 简单查看答案及解析
-
下列关于如图所示环状烃的叙述中正确的是
A. 它的分子中有3个五元碳环

B. 它应该具有和烷烃相似的化学性质
C. 它应该具有和芳香烃相似的化学性质
D. 它和甲烷属于同系物关系
难度: 中等查看答案及解析
-
常温时,将a1 mL b1 mol·L-1 HCl加入到a2 mL b2 mol·L-1 NH3·H2O中,下列结论正确的是
A. 若混合液的pH<7,则:a1b1=a2b2
B. 若a1=a2且混合液的pH>7,则b1<b2
C. 若a1=a2、b1=b2,则混合溶液中:
D. 若混合后溶液pH=7,则混合溶液中:
难度: 中等查看答案及解析
-
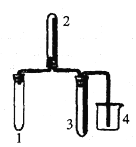
实验室欲用Cu片和浓HNO3反应制取适量NO2气体,下图中最适合完成该实验的简易装置是
A.
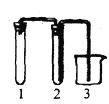 B.
B. 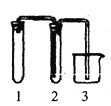
C.
 D.
D. 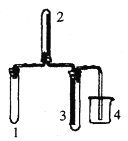
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A. 已知酸性
,物质的量浓度相等的NaF与
溶液中:c

B. 0.lmol·L-1的NaHX溶液pH为4,该溶液中:

C. 氯水中:

D. 25°C时,pH=8的
溶液中,
约为10-6mol·L-1
难度: 中等查看答案及解析
-
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
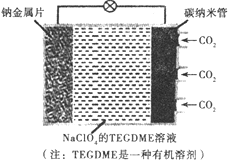
A. 充电时,Na+从阳极向阴极移动
B. 可以用乙醇代替TEGDME做有机溶剂
C. 放电时,当转移1mol电子负极质量减轻23g
D. 放电时,正极反应为3CO2 + 4Na++4e- = 2Na2CO3 + C
难度: 困难查看答案及解析
-
t℃时,AgX(X=CI、Br)的溶度积与c(Ag+)和c(X-)的相互关系如图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. AgCl(s)+Br-(aq) →AgBr(s)+CI(aq)平衡常数K=10-4
D. a点AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
,
。然后在恒定温度下缩小容器体积,重新达到平衡。下列分析正确的是
A. 若
,则该反应达到平衡状态
B. 两次平衡时,后一次平衡时
的浓度大
C. 重新达到平衡,密闭容器中氨气的体积分数不变
D. 若开始时向容器中加人2molNH3和1molCO2,则达到平衡时放出akJ热量
难度: 中等查看答案及解析
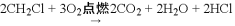 )
) )
)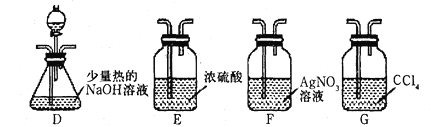


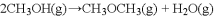
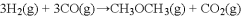 的
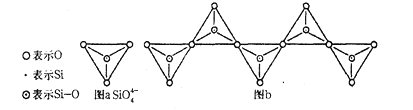
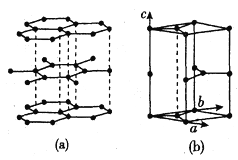
的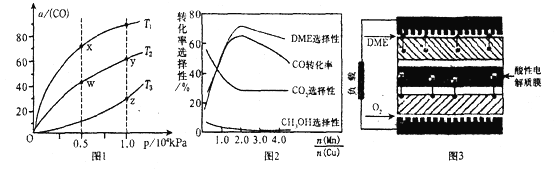

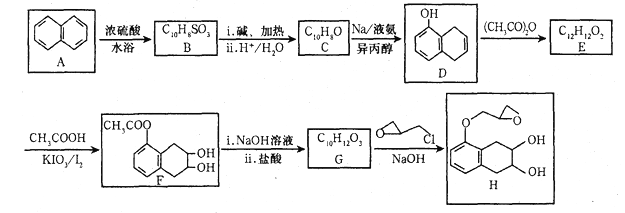
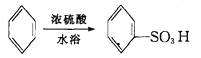
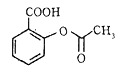 的合成路线补充完整。
的合成路线补充完整。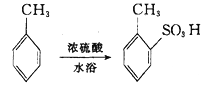 ___________________。
___________________。