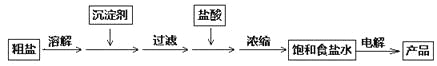
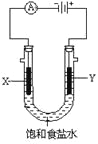
-
下列关于化学变化的叙述错误的是
A. 化学变化一定伴随能量变化
B. 化学变化一定有化学键的断裂和生成
C. 化学变化一定伴随物质的状态变化
D. 化学变化一定有新物质生成
难度: 简单查看答案及解析
-
中和热测定实验中,通过简易量热计直接测得的数据是
A. 反应的热量变化 B. 体系的温度变化
C. 酸或碱的浓度变化 D. 生成水的物质的量
难度: 中等查看答案及解析
-
下列溶液一定呈酸性的是
A. pH<7的溶液 B. c(H+)>c(OH—) 的溶液
C. pH>7的溶液 D. c(H+)<c(OH—) 的溶液
难度: 简单查看答案及解析
-
下列过程中需要通电才可以进行的是
①电离 ②电解 ③电镀 ④电化学腐蚀
A. ①②③ B. ②③④ C. ②③ D. 全部
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A. 化学反应速率 B. 化学反应的平衡常数
C. 水的离子积 D. 吸热反应反应物的转化率
难度: 中等查看答案及解析
-
下列说法正确的是
A. 放热反应一定能自发进行,吸热反应一定不能自发进行
B. 化学反应的反应热不仅与体系的始态和终态有关,也与反应的途径有关
C. 催化剂不仅能加快反应速率,也能增大反应物的转化率
D. 升高温度,能提高活化分子百分数,不能提高反应所需的活化能
难度: 中等查看答案及解析
-
下列物质加入水中,对水的电离能产生促进作用的是
A. NH4Cl B. NaOH C. NaCl D. H2SO4
难度: 中等查看答案及解析
-
下列关于原电池、电解池的叙述中正确的是
A. 发生氧化反应的电极分别为负极和阴极
B. 阴离子分别向负极和阴极迁移
C. 电子流向分别由负极直接流向正极、阴极直接流向阳极
D. 若都有一个电极质量减轻,应分别为负极和阳极
难度: 中等查看答案及解析
-
下列有关钢铁的腐蚀和防护的说法中正确的是
A. 钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同
B. 镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀
C. 将铁件与电源正极相连,可实现电化学保护
D. 将钢管与铜管堆放在一起,可保护钢管少受腐蚀
难度: 中等查看答案及解析
-
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A.
υ(NH3) =υ(O2) B.
υ(O2) =υ(H2O)
C.
υ(NH3) =υ(H2O) D.
υ(O2) =υ(NO)
难度: 中等查看答案及解析
-
一定温度下,可逆反应 A2(g)+3B2(g)
2AB3(g) 达到平衡的标志是
A. 容器内每减少1mol A2,同时生成2mol AB3
B. 容器内每减少1mol A2,同时生成3mol B2
C. 容器内A2、B2、AB3的物质的量之比为1:3:2
D. 容器内A2、B2、AB3的物质的量浓度相等
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 某离子被沉淀完全是指该离子在溶液中的浓度变为0
B. 某物质的溶解性为难溶,则该物质的溶解度为0
C. 一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物
D. 沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动
难度: 中等查看答案及解析
-
下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
A. Na2CO3 B. AlCl3 C. NaCl D. NH4Cl
难度: 中等查看答案及解析
-
已知反应 ①
②稀溶液中,
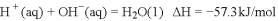 ,下列结论正确的是
,下列结论正确的是A. 碳的燃烧热为110.5kJ/mol
B. 2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ
C. 0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
下列实验,不能说明乙酸是弱电解质的是
A. 常温时,测得乙酸钠溶液的pH>7
B. 常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C. 乙酸溶液与大理石反应产生气泡
D. 相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
难度: 中等查看答案及解析
-
某密闭容器中发生如下反应 X(g)+3Y(g)
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是

A. t2时加入了催化剂
B. t3时减小了体系压强
C. t5时升高了体系温度
D. t2、t3、t5变化后反应物转化率均比t1时减小
难度: 中等查看答案及解析
-
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l),下列说法错误的是
A. 放电时覆盖PbO2的电极为正极,发生还原反应
B. 放电时电解质溶液中的H+向正极移动
C. 充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq)
D. 充电时电解质溶液的pH逐渐增大
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A. 使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B. 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. 由水电离出的c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D. 与铝作用能产生氢气的溶液:Al3+、K+、SO42-、CO32-
难度: 中等查看答案及解析
-
某碱性溶液中只含有Na+、CH3COO-、H+、OH-,下列说法正确的是
A. 溶液中离子浓度可能满足:c(Na+)>c(OH-) >c(H+)>c(CH3COO-)
B. 溶液中离子浓度一定满足:c(Na+)= c(CH3COO H)+ c(CH3COO-)
C. 向溶液中加入适量醋酸,离子浓度可能满足:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. 该溶液可能由pH=11的NaOH溶液和pH=3的醋酸溶液等体积混合而成(常温时醋酸的电离常数为1.75×10-5)
难度: 困难查看答案及解析
-
一定温度下,氯化银在水中存在溶解平衡 AgCl(s)
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
A. ③>①>②>④ B. ②>①>④>③ C. ④>③>②>① D. ①>③>④>②
难度: 中等查看答案及解析
-
用惰性电极电解物质的量浓度相等的CuSO4、NaCl混合溶液,电解过程中不可能发生的反应是
A. 2Cl-+Cu2+
Cu+Cl2↑
B. 2Cl-+2H2O
H2↑+Cl2↑+2OH-
C. 2Cu2++2H2O
2Cu+O2↑+4H+
D. 2H2O
2H2↑+O2↑
难度: 中等查看答案及解析