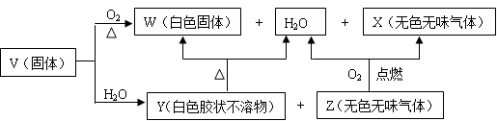
-
如何解决好碳排放问题是关系到人类可持续发展的重大课题之一。目前,采用较多的方法是对二氧化碳进行捕集封存和富集再利用。下列与二氧化碳有关的叙述正确的是
A.CO2是形成酸雨的主要物质
B.CO2导致温室效应,是一种大气污染物
C.CO2(g)+C(s)
2CO(g)
H>0,高温有利于该反应自发进行
D.实验室常用大理石与稀盐酸或稀硫酸反应制取二氧化碳
难度: 中等查看答案及解析
-
2015年9月28日,美国宇航局宣布发现了火星上存在液态水的证据。下列关于水的叙述正确的是:
A.水是一种重要的溶剂,能溶解所有的无机物和大多数有机物
B.水是一种重要的化学试剂,在一定条件下可与许多无机物和有机物发生反应
C.在氧化还原反应中,水只能作氧化剂,不能作还原剂
D.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,在上述方法中都有化学反应发生
难度: 中等查看答案及解析
-
钢化玻璃俗称普通玻璃的化身,是普通玻璃经一定物理方法处理后得到的。钢化玻璃一般不会发生自爆现象,但当钢化玻璃中含有硫化镍结核时就有可能发生自爆现象。下列有关说法中错误的是
A.制取钢化玻璃的原料为石灰石、纯碱和石英
B.钢化玻璃是一种新型无机非金属材料
C.制取钢化玻璃的主要反应都是非氧化还原反应
D.在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢
难度: 中等查看答案及解析
-
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质——吲哚乙酸,吲哚乙酸的结构如图所示。下列有关吲哚乙酸的说法中正确的是
A.吲哚乙酸与苯丙氨酸互为同分异构体
B.吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应
C.1 mol吲哚乙酸与足量氢气
发生加成反应时,可以消耗5 mol H2
D.吲哚乙酸苯环上的二氯代物共有四种结构
难度: 困难查看答案及解析
-
白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4 +24H2O
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是
A.在上述两个反应中,水既不是氧化剂也不是还原剂
B.在上述两个反应中,氧化产物都是H3PO4
C.在反应(2)中,当有5 mol CuSO4发生反应时,共转移10 mol电子
D.在上述两个反应中,氧化剂都只有硫酸铜
难度: 困难查看答案及解析
-
下列有关叙述中正确的是
A.CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键
B.在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键
C.5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2×6.02×1023个电子
D.6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子
难度: 困难查看答案及解析
-
Bodensteins研究了下列反应:2HI(g)
H2(g)+I2(g)
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是

A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同
难度: 极难查看答案及解析