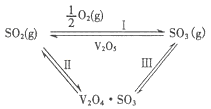
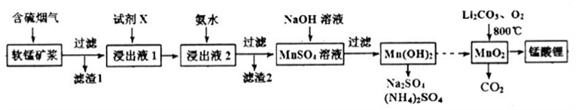
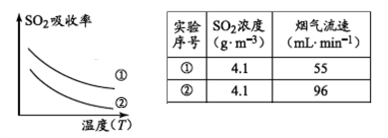
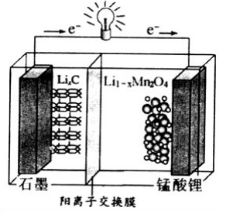
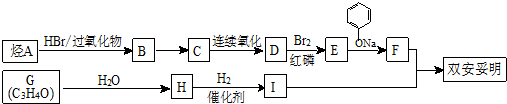
-
化学与生活、社会可持续发展密切相关,下列叙述错误的是
A. CO2的大量排放会导致酸雨的形成
B. 黄河三角洲的形成体现了胶体聚沉的性质
C. 推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放
D. 轮船上挂锌锭防止铁腐蚀,属于牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18g重水(D2O)所含的电子数为10NA
B. 常温常压下,0.3molNO2完全与水反应,转移的电子数为0.2NA
C. 标准状况下,22.4LCCl4中含有NA个CCl4分子
D. 常温下, 1L0.1mol/LCH3COONH4溶液中NH4+离子数为0.1NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A. NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存
B. H2O2的电子式是:
C. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 铁锈是化合物,可用Fe2O3·nH2O(2<n<3)表示
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,W原子的质子数是其最外层电子数的三倍。下列说法不正确的是
A. 元素Y有同素异形体 B. 最高价氧化物对应水化物的酸性:X>Z
C. 简单气态氢化物的热稳定性:Y>Z D. 原子半径:W>Z>Y>X
难度: 中等查看答案及解析
-
下列实验操作和理象、结论均正确且有因果关系的是
选项
实验操作和现象
结论
A
向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色
原溶液中含有I-
B
常温下,0.1mol/LNaHSO3溶液的pH约为5
HSO3-的电离程度大于其水解程度
C
相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH
亚硫酸的酸性强于碳酸
D
向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色
稀HNO3将Fe氧化为Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
可逆反应L(s )+aG(g)⇌bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强pl>p2。下列判断正确的是
A. 1+a<b B. △H<0 C. a>b D. 增加L的物质的量,可提高G的转化率
难度: 中等查看答案及解析
-
在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
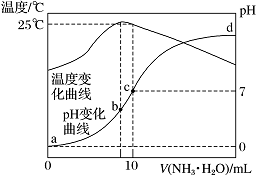
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=
难度: 困难查看答案及解析