-
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为_______;化合物ABD的结构式为______,其中B原子的杂化方式为________。
(3)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的c(H+)甲/c(H+)乙=_________;乙溶液中所含离子的物质的量浓度由大到小的顺序是___________。
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为______________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是_________________。
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为___________。
难度: 中等查看答案及解析
-
“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键
C—H
C=O
H—H
C
O(CO)
键能/kJ·mol−1
413
745
436
1075
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3−)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
难度: 中等查看答案及解析
-
利用钛白粉厂的废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
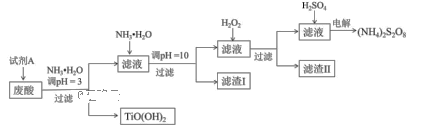
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子
TiO2+
Fe3+
Fe2+
Al3+
开始沉淀的PH
1.2
1.9
7.0
3.2
沉淀完全的pH
2.8
3.1
9.4
4.7
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为__________
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_____(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式: 2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O 。
(5)电解制备过二硫酸铵的装置如下图所示。
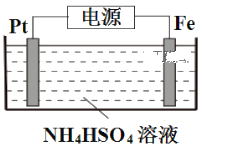
①S2O82-中S元素的化合价为+6,1mol S2O82-过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为___________,阳极的电极反应式为______________________。
难度: 中等查看答案及解析