-
化学与生产生活息息相关,下列说法正确的是
A. 熔融烧碱时,可以选用耐高温的陶瓷坩埚
B. 空气中的粉尘可以利用胶体的带电性加以清除
C. 用电化学氧化的方法,可以在铝的表面生成坚硬的氧化膜
D. 聚氯乙烯、有机玻璃、合成橡胶、酚醛树脂都是由缩聚反应制得的
难度: 中等查看答案及解析
-
下列叙述在确的是
A. 等质量的CO与N2,质子数之比为1︰1
B. 标况下,相同体积的H2O和NH3含有的电子数相同
C. 1molO2分别与足量S、SO2反应,转移的电子数相同
D. 2 mol/L NH4CI溶液与1mol/L(NH4)2SO4溶液中,NH4+数目相同
难度: 中等查看答案及解析
-
蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是

A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
难度: 中等查看答案及解析
-
W、Ⅹ、Y、Z为原子序数依次增大的短周期主族元素,其中,W是最轻的金属。X与Y组成的化合物被称为“信息高速公路的骨架”,氢氟酸是唯一可以与之发生反应的酸。Z的最外层电子数为电子层数的2倍。下列说法正确的是
A. 单质的熔点:Z>Y
B. 简单氢化物的稳定性:X>Y
C. 金属W在空气中加热生成W2O2
D. W、Y的单质分别与氯气反应的产物所含的化学键类型相同
难度: 中等查看答案及解析
-
NO2、O2和熔融NaNO3可制作燃料电池,其原理如图。该电池在使用过程中石墨1电极上生成氧化物Y。下列说去错误的是
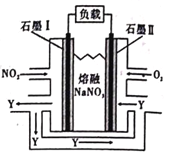
A. 若将该电池中的熔融NaNO3换成NaOH溶液,则不可能产生电流
B. 该电池放电时NO3-从右侧向左侧迁移
C. 石墨I电极的电极反应式为NO2+NO3--e-=N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4︰1
难度: 中等查看答案及解析
-
下列实验操作、现象和实验结论均正确的是
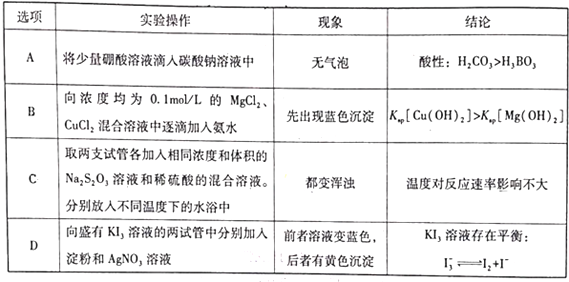
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
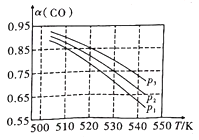
常温时,向0.1moLH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。已知常温下,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。下列说法错误的是
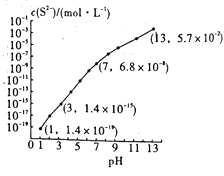
A. 当溶液中c(S2-)=1.4×10-19mol/L时,溶液中由水电离出的H+浓度为1.0×10-13mo/L
B. 0.1mo/LNa2S溶液中离子浓度之间的关系为:c(Na+)>c(HS-)+2c(S2-)
C. 常温下,0.1 mol/L NaHS溶液的pH<7
D. 当pH=13时,溶液中的c(H2S)+c(HS-)=0.043mo/L
难度: 困难查看答案及解析
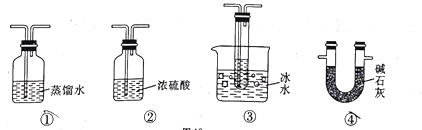
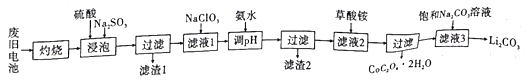
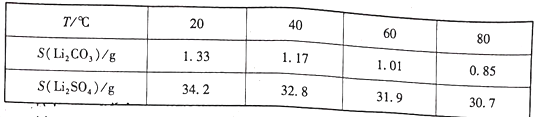
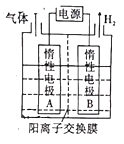

 ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。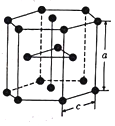
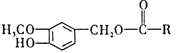 (R为烃基)。图27为一种辣椒素酯J的合成路线:
(R为烃基)。图27为一种辣椒素酯J的合成路线: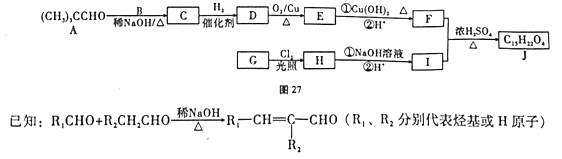
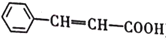 )的合成路线。___________________
)的合成路线。___________________