-
下列说法正确的是:
A. 煤经过气化和液化等物理变化可转化为清洁燃料
B. 天然植物油常温下一般呈液态,有恒定的熔点、沸点
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 氯化钠是生活中常见的调味品和防腐剂
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列说法正确的是:
A. 标准状况下,11.2LH2O所含分子数大于0.5NA
B. 1mol淀粉水解后产生的葡萄糖分子数为NA
C. 1LpH=12的氢氧化钡溶液中OH-的数目为0.02NA
D. 15gCH3+(碳正离子)中含有电子数为10NA
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. 蔗糖水解生成的两种有机物互为同分异构体
B. 含有5个碳原子的饱和链烃,其一氯代物有3种
C. 乙烷与氯气在光照下发生反应的产物可能有10种
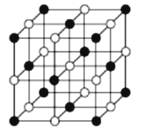
D. 金刚烷的结构为
,它的二氯化物有六种(不考虑立体异构)
难度: 中等查看答案及解析
-
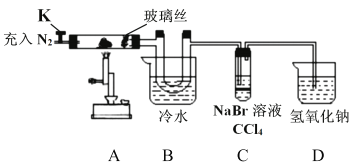
下列实验操作、实验现象及日的均正确的是:
选项
实验操作
实验现象及目的
A
向淀粉溶液中滴入硫酸,加热一段时间后,滴入银氨溶液,水浴加热。
有银镜现象出现,验证酸性条件下淀粉水解
B
向Fe(NO3)2加入稀硫酸
溶液绿色加深,验证Fe2+水解平衡受外界影响
C
用天平、烧杯、量筒、胶头滴管、玻璃棒配制溶液
配制一定质量分数的溶液
D
将适量Cl2通入NaBr溶液中,再加入裂化汽油,振荡,静置。
上层溶液呈橙红色,Cl2的氧化性大于Br2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,Wˉ与X+电子层结构相同,Y所在周期数与族序数相同,Z的最高价氧化物的水化物为强酸。下列说法正确的是:
A. 简单离子半径:X>Y>Z>W
B. W、Z对应氢化物的沸点:W>Z
C. 周期表中Z的氧化物对应水化物的酸性最强
D. 工业上用电解XZ的水溶液制备X单质
难度: 中等查看答案及解析
-
有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
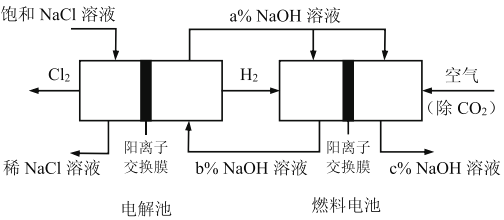
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
难度: 困难查看答案及解析
-
化学上常用AG表示溶液中的酸碱度,AG=
。25℃时,用0.100mol/L的NaOH溶液滴定20.00m 0.100mol/L的醋酸溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法错误的是:

A. 点C时溶液存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B. 点B时溶液存在2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C. 25℃时,醋酸的水解常数Kh=10-4.5
D. 点D溶液的pH=11.25
难度: 困难查看答案及解析


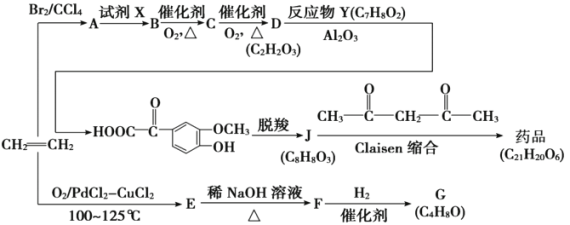
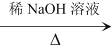
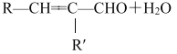 (R、R表示烃基或氢)。
(R、R表示烃基或氢)。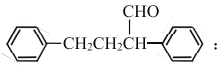 _________________________________。
_________________________________。