-
下列叙述正确的是
A. 吸热反应一定是反应物总能量大于生成物的总能量
B. 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C. 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
难度: 中等查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法错误的是
A. 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
C. 2012年3月修订的《环境空气质量标准》中新纳入的监测指标是PM2.5
D. 防止酸雨发生的重要措施之一是使用清洁能源
难度: 简单查看答案及解析
-
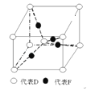
关于金刚石、石墨和C60的判断,正确的是
A. 均含共价键 B. 互为同分异构体 C. 互为同位素 D. 性质相同
难度: 简单查看答案及解析
-
下列说法正确的是
A. 氢氧化铁胶体属于纯净物 B. Na2O2是碱性氧化物
C. BaSO4是强电解质 D. 纯碱属于碱类物质
难度: 简单查看答案及解析
-
下列有关元素性质比较正确的是
A. 碱性:NaOH < Mg(OH)2< Al(OH)3 B. 氢化物稳定性: HF>HCl>PH3
C. 原子半径:S>F>O D. 酸性:HClO > HNO3 > H2CO3
难度: 中等查看答案及解析
-
下列关于有机物的说法,正确的是
A. 聚乙烯和乙烯性质相似,都能发生加成反应
B. 纤维素、橡胶和光导纤维都属于有机高分子化合物
C. 乙烯和乙醇都可发生加成反应
D. 等量的CH4和Cl2在光照下反应不能生成纯净的CH3Cl
难度: 中等查看答案及解析
-
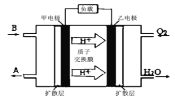
关于下列各实验或装置的叙述中,正确的是
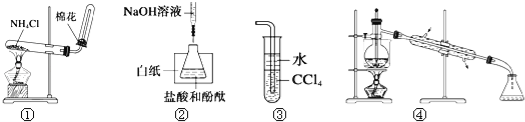
A. 实验①可用于制取氨气
B. 实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点
C. 装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸
D. 装置④可用于从酒精水溶液中制取无水乙醇
难度: 中等查看答案及解析
-
下列有关表示正确的是:
A. 过氧化钙(CaO2)的电子式:
B. 某微粒的结构示意简图为
,则该元素在周期表中位于第三周期、VIA族
C. H2CO3的电离方程式:H2CO3⇌2H++CO32﹣
D. 葡萄糖的结构简式:C6H12O6
难度: 中等查看答案及解析
-
下列叙述正确的是:
A. Li在氧气中燃烧能生成Li2O2
B. 将SO2通入过量FeCl3和BaCl2的混合溶液中可生成BaSO4沉淀
C. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后最终溶液呈红色
D. 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象
难度: 中等查看答案及解析
-
下列说法不正确的是
A. C2H4Cl2有三种同分异构体
B. 将苯与浓硝酸和浓硫酸共热制取硝基苯
C. 将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛
D. 可用浓硝酸鉴别淀粉溶液和鸡蛋白溶液
难度: 中等查看答案及解析
-
短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
A. R的氢化物可以既有极性键又有非极性键
B. 常温下丁的浓溶液可用T单质所制的容器来盛装
C. 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D. 甲、乙、丙、丁受热均易分解
难度: 中等查看答案及解析
-
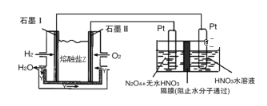
关于下列各装置图的叙述不正确的是
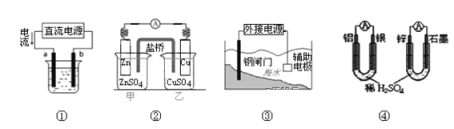
A. 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B. 图②装置盐桥中KCl的Cl﹣移向甲烧杯
C. 图③装置中钢闸门应与外接电源的正极相连获得保护
D. 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 中等查看答案及解析
-
下列说法不正确的是:
A. 某温度下,水的离子积常数Kw=10﹣13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=1:10
B. 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
C. 常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子浓度均降低
D. 甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
难度: 困难查看答案及解析
-
下述实验能达到预期目的是:
A. 将SO2通入酸性KMnO4 溶液中,紫色褪去 证明SO2具有漂白性
B. 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液后红色褪去 证明Na2CO3溶液中存在水解平衡
C. 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红褐色沉淀 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度
D. 测定等物质的量浓度的HCl与H2S溶液的pH,后者较大 证明非金属性Cl>S
难度: 中等查看答案及解析
-
已知电离平衡常数:H2CO3>HClO>HCO3﹣,氧化性:HClO>Cl2>Br2>Fe3+,下列有关的离子方程式正确的是
A. 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH﹣+CO2═HCO3﹣
B. 向NaClO溶液中加入浓氢溴酸:ClO﹣+2H++2 Br﹣═Cl﹣+Br2+H2O
C. 向NaClO溶液中通入少量二氧化碳:2ClO﹣+CO2+H2O═2HClO+CO32﹣
D. 向FeBr2溶液中滴加少量Cl2溶液:2 Br﹣+ Cl2═Br2+2Cl﹣
难度: 困难查看答案及解析
-
下列有关溶液中粒子浓度的关系式中一定不正确的是
A. 在常温下,0.10mol·L-1Na2CO3溶液25mL 用0.10mol·L-1盐酸滴定,当滴定到消耗20mLHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3)
B. pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
C. 25℃时,0.1 mol•L﹣1pH=4.5的NaHSO3溶液中:c(HSO3﹣)>c(H2SO3)>c(SO32﹣)
D. 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO﹣)﹣c(CH3COOH)=2[c(H+)−c(OH−)]
难度: 中等查看答案及解析
-
现有由两种可溶性化合物配成的混合溶液,且浓度均为0.1mol•L﹣1,其中阳离子可能是Fe2+、Al3+、Fe3+、H+,阴离子可能是NO3﹣、CO32﹣、I﹣、Cl﹣.若向溶液中加少量盐酸,则溶液变成黄色,且有气体生成.若不计水电离产生的少量离子,则下列说法一定正确的是
A. 向溶液中加少量盐酸时,生成的气体可能含有CO2
B. 原溶液中一定含有NO3﹣、Fe2+,一定不含Fe3+、H+、CO32﹣
C. 原溶液中一定含有的离子为NO3﹣,可能含有Fe2+、I﹣
D. 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
甲
乙
丙
丁
起始物质的量
n(SO2)/mol
0.40
0
0.80
0.02
n(O2)/mol
0.24
0
0.48
0.04
n(SO3)/mol
0
0.40
0
0.40
含硫反应物的平衡转化率%
80
1
2
3
下列判断中,正确的是
A. 该温度下,平衡常数的值为400 B. 平衡时,丙中c(SO3)是甲中的2倍
C. 平衡时,ɑ3>ɑ1 D. 乙中SO3的平衡转化率为ɑ1 = 20%
难度: 困难查看答案及解析
-
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:(已知Ksp=3.810﹣38; Ksp=210﹣20;Ksp(ZnS)=1.610﹣24)
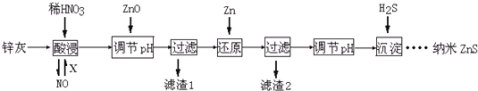
下列说法不正确的是:
A. 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++ NO3﹣═3Fe3++NO↑+5H2O
B. 将酸浸的尾气循环利用,加入的X气体可以是O2
C. 滤渣2中的成分是Zn和Fe
D. 当溶液中Zn2+浓度为小于1.010﹣5mol•L﹣1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2﹣浓度应大于1.610﹣19mol•L﹣1
难度: 困难查看答案及解析