-
利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是( )
A. 可生成H2的质量为0.02g
B. 可生成氢的原子数为2.408×1023个
C. 可生成H2的体积为0.224L(标准状况)
D. 生成H2的量理论上等于0.04mol Na与水反应产生H2的量
难度: 中等查看答案及解析
-
用如图所示实验装置进行相关实验探究,其中装置不合理的是( )
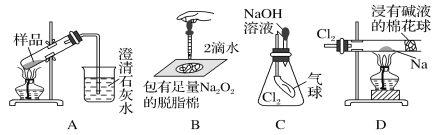
A. 鉴别纯碱与小苏打 B. 证明Na2O2与水反应放热
C. 证明Cl2能与烧碱溶液反应 D. 探究钠与Cl2反应
难度: 中等查看答案及解析
-
常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaC1
与NaC1O)。下列说法正确的是(NA代表阿伏加德罗常数)
A. 氯气的体积为1.12L B. 原烧碱溶液中含溶质离子0.2NA
C. 所得溶液中含OH-的数目为1×10-5NA D. 所得溶液中ClO-的数目为0.05NA
难度: 简单查看答案及解析
-
下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是
A. Cu+H2SO4
CuSO4+SO2↑+H2O
B. CH3COOH+Ca(ClO)2
HClO+Ca(CH3COO)2
C. I2+NaClO3
NaIO3+Cl2
D. HCl+MnO2
MnCl2+Cl2↑+H2O
难度: 中等查看答案及解析
-
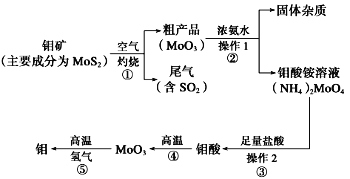
Al与Na2O2的混合物溶于足量的水中,得到澄清溶液,同时产生气体3.5 g,在所得溶液与100 mL 7mol/L盐酸作用过程中,白色沉淀生成后又恰好溶解,则原Al与Na2O2的物质的量之比为
A. 2∶1 B. 1∶2 C. 11∶2 D. 2∶11
难度: 困难查看答案及解析
-
向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。生成的沉淀过滤除去后,则下列离子组在对应的溶液中一定能大量共存的是
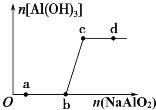
A. a点对应的溶液中:Na+、K+ HCO3- Cl-
B. b点对应的溶液中:Na+、OH-、SO42-、Cl-
C. c点对应的溶液中:Na+、K+、Ag+、NO3-
D. d点对应的溶液中:Na+、K+、OH-、Cl-
难度: 困难查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知
类推
A
将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+
将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+
B
稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
C
铁和氯气反应2Fe+3Cl2
2FeCl3
铁和碘单质反应2Fe+3I2
2FeI3
D
向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:2C(s)+O2(g)= 2CO(g) ΔH=-217 kJ·mol-1,C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1,H—H、O—H和O=O键的键能分别为436 kJ·mol-1、462 kJ·mol-1和495 kJ·mol-1,则b为( )
A. +352 B. +132 C. -120 D. -330
难度: 简单查看答案及解析
-
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A. (
-
) mol/L B. (2b-a) mol/L
C. (5b-
) mol/L D. (10b-5a) mol/L
难度: 中等查看答案及解析
-
已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是
A. 只用盐酸一种试剂就可以确定该固体M的具体成分
B. 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C. 用pH试纸检验,若pH=7,则固体M一定是Na2SO4
D. 往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
难度: 中等查看答案及解析
-
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S
6Cu+SO2↑,对于该反应,下列说法正确的是
A. 该反应的氧化剂只有Cu2O B. Cu既是氧化产物,又是还原产物
C. Cu2S既是氧化剂又是还原剂 D. 还原产物与氧化产物的物质的量之比为1∶6
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A. D元素处于元素周期表中第3周期第ⅥA族
B. 四种元素的原子半径:A<B<C<D
C. B、D的最高价氧化物具有相似的物理性质和化学性质
D. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z在周期表中的位置如图。下列说法正确的是
A. Z元素的最高化合价一定大于X元素
B. 三种元素原子半径由高到低的顺序一定是Y>X>Z
C. 若它们的原子最外层电子数之和为11,则X为金属元素
D. 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,且W、X、Y、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是
A. X和其他三种元素均可形成至少2种二元化合物
B. W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C. W、X和Y三种元素可以形成碱性化合物
D. Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
难度: 简单查看答案及解析
-
a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a︰b不可能为
A. 3︰4 B. 3︰2 C. 2︰3 D. 4︰5
难度: 困难查看答案及解析