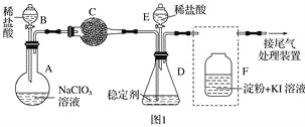
-
向足量H2SO4溶液中加入100mL 0.4mol•L﹣1Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol•L﹣1HCl溶液时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣2.92kJ•mol﹣1
B. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣0.72kJ•mol﹣1
C. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣73kJ•mol﹣1
D. Ba2+(aq)+SO42﹣(aq)=BaSO4(s)△H=﹣18kJ•mol﹣1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,pH=2的H2SO4溶液中含有的H+离子数目为0.01NA
B. 当H2O与Na2O2反应生成1 molO2时,转移的电子数目为4NA
C. 标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA
D. 1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
难度: 简单查看答案及解析
-
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
A. ②④ B. ③④ C. ③⑤ D. ①③
难度: 中等查看答案及解析
-
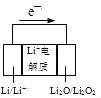
常用的电池是一个液体电解质将两个固体电极隔开。而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过。下列有关说法不正确的是
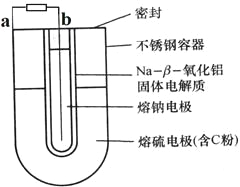
A. a为电池的正极
B. 充电时b接电源的正极
C. 正极反应为:nS8+16ne-=8Sn2-
D. Na+可以穿过固体电解质从而传递电流
难度: 中等查看答案及解析
-
下图是关于反应A2(g)+3B2(g)
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
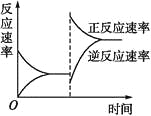
A. 升高温度,同时加压
B. 降低温度,同时减压
C. 增大反应物浓度,同时减小生成物浓度
D. 增大反应物浓度,同时使用催化剂
难度: 中等查看答案及解析
-
如图所示,在水槽中装入蒸馏水后,铁块腐蚀速率的大小顺序正确的是 ( )
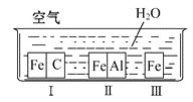
A. Ⅰ>Ⅱ>Ⅲ
B. Ⅰ>Ⅲ>Ⅱ
C. Ⅱ>Ⅰ>Ⅲ
D. Ⅱ>Ⅲ>Ⅰ
难度: 中等查看答案及解析
-
分子式为C5H10O2的酯共有(不考虑立体异构) :
A.7种 B.8种 C.9种 D.10种
难度: 中等查看答案及解析
-
下列有关电化学的装置完全正确的是( )
A. 铜的精炼
 B. 铁上镀银
B. 铁上镀银
C. 防止铁被腐蚀
 D. 构成铜锌原电池
D. 构成铜锌原电池
难度: 中等查看答案及解析
-
下列说法正确的是
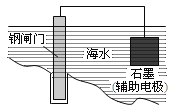
A. 用上图所示方法可保护钢闸门不被腐蚀
B. SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C. 常温下,NH4Cl溶液加水稀释,
增大
D. C(s)+H2O(g)
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
难度: 中等查看答案及解析
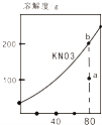 表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点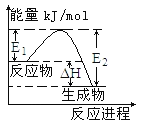 表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变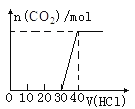 表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况
表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况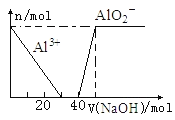 向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液
向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液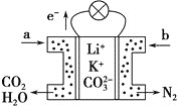
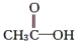 ,官能团是—OH
,官能团是—OH