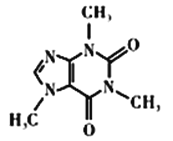
-
化学在生活中有着重要的应用。下列叙述不正确的是()
A. 2019年春节部分地方燃放的“烟花”应用了某些金属的焰色反应
B. 棉 麻 桑蚕丝均是天然有机高分子材料
C. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用稀硫酸反应即可
D. 医院常用体积分数为75%的酒精溶液进行消毒
难度: 中等查看答案及解析
-
常温下,下列各组离子(或在指定条件下)能大量共存的是
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
D. 使pH 试纸显蓝色的溶液中:K+、Na+、OH-、SO42-
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。Y的离子半径是同周期主族元素中最小的,Z原子最外层电子数是其内层电子数的3/5,下列说法中一定正确的是
A. W的氧化物对应水化物为强酸,具有强氧化性。
B. 简单离子半径:Y<W<X<Z
C. 简单氢化物沸点:Z<X
D. 工业上一般采取电解Y的熔融氯化物来生产Y的单质
难度: 中等查看答案及解析
-
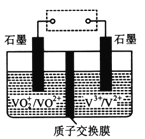
微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左图为其工作原理,右图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. 有机物被氧化,M为电源负极
B. 电池工作时,N极附近溶液pH增大
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. 处理0.1 mol Cr2O72-时有1.4 mol H+从交换膜左侧向右侧迁移
难度: 困难查看答案及解析
-
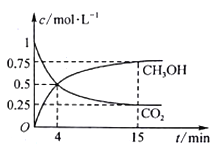
CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g)
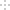 C2H4(g)+4H2O(g)。0.2 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述正确的是
C2H4(g)+4H2O(g)。0.2 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述正确的是
A. 该反应为吸热反应
B. 曲线a代表的是C2H4
C. N点和M点所处状态的c(H2O)相等
D. 其它条件不变,T1℃、0.1 MPa下反应达平衡时CO2的转化率比N点更大
难度: 中等查看答案及解析
-
根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是
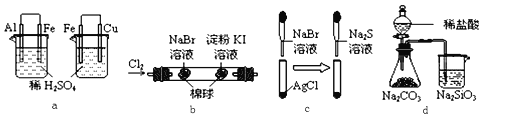
选项
实验
实验现象
结论
A
a
左烧杯中铁表面有气泡,右烧杯中铜表面有气泡
活动性:Al>Fe>Cu
B
b
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
c
白色固体先变为淡黄色,后变为黑色
溶解度:AgCl < AgBr < Ag2S
D
d
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )

A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
难度: 困难查看答案及解析
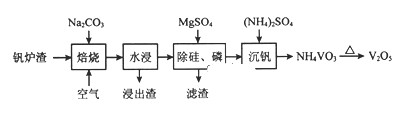

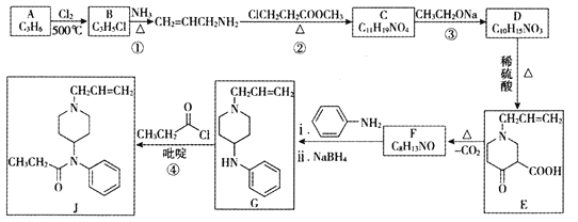
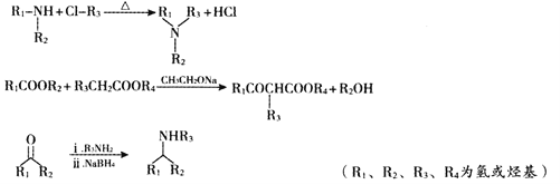
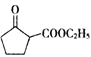 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(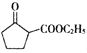 的合成路线____________________。(已知:RCH=CHR’
的合成路线____________________。(已知:RCH=CHR’