-
化学与生产、生活密切相关,下列说法正确的是
A. “地沟油”禁止食用,但可以用来制肥皂
B. 向豆浆中加入硫酸铜,会使蛋白质发生聚沉而制得豆腐
C. 纤维素在人体内可水解为葡萄糖,故可做人类的营养物质
D. 合成纤维、人造纤维及碳纤维都属于有机高分子材料
难度: 中等查看答案及解析
-
宋代《开宝本草》记载,“(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。该制取KNO3的方法是
A. 过滤 B. 蒸馏 C. 重结晶 D. 升华
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 乙醇的分子式:C2H5OH B. 次氯酸的电子式:
C. 氯原子的结构示意图:
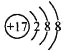 D. 中子数为146、质子数为92的铀(U)原子:
D. 中子数为146、质子数为92的铀(U)原子:难度: 中等查看答案及解析
-
下列关于工业生产的说法中不正确的是
A. 玻璃、水泥、陶瓷工业中,石灰石都是主要的生产原料
B. 在氯碱工业中,电解槽被离子交换膜隔成阴极室和阳极室
C. 在合成氨工业中,采用循环操作提高原料利用率
D. 在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
难度: 中等查看答案及解析
-
室温时,下列各组离子一定能大量共存的是
A. pH=1的溶液中:K+、Fe2+、Cl-、NO3-
B. 含大量Fe3+溶液中:NH4+、Na+、HCO3-、Cl-
C. 在c(H+)=1×10-13mo1/L溶液中:NH4+、A13+、SO42-、NO3-
D. 在强碱溶液中:Na+、K+、[A1(OH)4]-、CO32-
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 乙烯与SO2均能使溴水褪色,且褪色原理相同
B. C4H10有三种同分异构体,它们的熔点、沸点各不相同
C. 酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
D. 甲烷和Cl2的反应与乙烯和Br2的反应属于同一反应类型
难度: 中等查看答案及解析
-
下列物质转化在给定条件下每一步都能实现的是
A. Si
SiO2
H2SiO3
B. Mg(OH)2
MgCl2(aq)
Mg
C. Al2O3
A1Cl3(aq)
无水AlCl3
D. CH3CHO
CH3COOH
CH3COOCH3
难度: 困难查看答案及解析
-
用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如下图所示。下列说法不正确的是
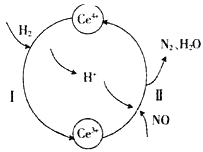
A. 反应I的离子反应方程式为2Ce4++H2=2Ce3++2H+
B. 反应II中氧化剂与还原剂的物质的量之比为1:2
C. 反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+)
D. 反应过程中混合溶液内Ce3+和Ce4+离子的总数一定保持不变
难度: 中等查看答案及解析
-
下列实验操作或装置(略去部分夹持仪器)正确的是
A. 蒸发结晶

B. 中和滴定

C. 制MgCl2
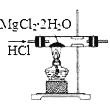
D. 制乙酸乙酯
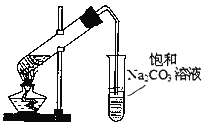
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 2.24L N2和2.24L CO所含电子数均为1.4 NA
B. 300 mL 2mol·L-1蔗糖溶液中所含分子数为0.6NA
C. 1mol Na2O2固体中含离子总数为4NA
D. 42g乙烯和丙烯混合气体中氢原子的个数为6NA
难度: 中等查看答案及解析
-
实验室制备下列气体时,所用方法正确的是
A. 制二氧化氮时,用水或NaOH溶液吸收尾气
B. 制氨气时,用向下排空气法收集气体
C. 制乙烯时,可选择与实验室制Cl2相同的气体发生装置
D. 用锌粒与稀盐酸制氢气时,用饱和NaHCO3溶液和浓硫酸净化气体
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如下图,其中只有Z为金属元素。下列说法不正确的是( )
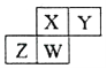
A. 原子半径W>Y
B. X的最简单气态氢化物的热稳定性比W的小
C. Z元素的氧化物既能与强酸反应又能与强碱反应
D. Y的氢化物能与其最高价含氧酸反应生成离子化合物
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 用食醋溶解水垢:2H++CaCO3=Ca2++H2O+CO2↑
B. Ba(OH)2溶液中加NaHSO4溶液至中性Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. 碳酸氢钠溶液中加入过量氢氧化钙:HCO3-+OH-+Ca2+=CaCO3↓+H2O
D. 稀硝酸中加入过量铜片:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
难度: 中等查看答案及解析
-
“钙基固硫”是将煤中的硫元素以CaSO4的形式固定脱硫,而煤炭燃烧过程中产生的CO又会发生反应I和反应II,导致脱硫效率降低。某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是
反应I:CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
反应II:CaSO4(s)+4CO(g)
CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
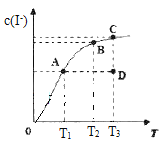
A. 该反应△H<0
B. 若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I3-)大
难度: 困难查看答案及解析
-
利用下图所示装置一定条件下可实现有机物的电化学储氢(忽略其他有机物)。下列说法不正确的是

A. A为电源的负极
B. E极的电极式为2H2O-4e-=4H++O2↑
C. D极生成目标产物的电极式为C6H6+6H++6e-=C6H12
D. 该装置的电流效率
75%
 ,则b中环己烷增加2.8mol
,则b中环己烷增加2.8mol难度: 困难查看答案及解析





 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。